oct
24
 La supervivencia libre de progresión fue mayor con quimioterapia específica ‘versus’ la estándar en 2 ensayos, pero hace falta mejorar el pronóstico del paciente.
La supervivencia libre de progresión fue mayor con quimioterapia específica ‘versus’ la estándar en 2 ensayos, pero hace falta mejorar el pronóstico del paciente.
Los cánceres de origen primario desconocido (CUP) tienen un mal pronóstico debido a la falta de estudios estandarizados destinados a identificar el lugar del tumor primario. Así, las Guías de práctica clínica de la ESMO resaltan la necesidad de nuevos datos para respaldar técnicas como la secuenciación de próxima generación para identificar posibles objetivos terapéuticos (Ann Oncol 2023;34:228–246). Precisamente, en el Congreso ESMO 2023, que se celebra en Madrid, se han presentado alentadores datos de estudios relacionados con la medicina de precisión para CUP.
Los resultados del ensayo CUPISCO de fase II (LBA16) mostraron una mediana de supervivencia libre de progresión (SLP) significativamente mejorada, el criterio de valoración principal del estudio, en pacientes que recibieron terapia guiada molecularmente (MGT; 6,1 meses) frente a la quimioterapia estándar basada en platino (4,4 meses), con un índice de riesgo (HR) de 0,72 (intervalo de confianza [IC] del 95 %: 0,56-0,92; p = 0,0079).
Los datos de supervivencia general (SG) fueron inmaduros, pero tendieron a mejorar con MGT (HR 0,82; IC 95 % 0,62–1,09; p = 0,1779). Las tasas de respuesta objetiva fueron del 17,8% con MGT y del 8,2% con quimioterapia, con duraciones de respuesta similares (HR 0,95; IC 95 %: 0,33–2,72). Las tasas de eventos adversos fueron generalmente similares o menores con MGT versus quimioterapia y no hubo diferencias entre los brazos de tratamiento en las medidas de calidad de vida.
En CUPISCO, los pacientes con CUP no escamoso, desfavorable y recién diagnosticado recibieron 3 ciclos de quimioterapia de inducción; luego, aquellos con control de la enfermedad fueron aleatorizados 3:1 a MGT (n=326; elección del investigador después del consejo de la junta de tumores moleculares) o ≥3 ciclos más de quimioterapia basada en platino (n = 110).
Olivier Michielin, de los Hospitales Universitarios de Ginebra (Suiza), consideró alentadores los datos del estudio y añadió que «este es un ensayo positivo para los CUP, que se suma al conjunto de evidencia para un enfoque de precisión en una población de pacientes cuyo estándar de atención no es satisfactorio». Sin embargo, añadió, «sabemos que los pacientes con CUP generalmente tienen un mal pronóstico e incluir en el ensayo solo a pacientes con control de la enfermedad después de 3 ciclos de quimioterapia podría seleccionar casos de pacientes más favorables. Esto debe tenerse en cuenta al interpretar los resultados. El hecho de que este ensayo cambie la práctica depende de la ubicación: puede que los pacientes ya hayan sido remitidos a programas de perfiles genómicos y de oncología de precisión en algunos centros, pero esto no siempre está disponible».
Avanza la oncología de precisión: se adelanta el diagnóstico en sangre y llega una nueva familia terapéutica
Smartphones; cuando la tecnología ayuda a detectar cáncer a miles de kilómetros
La medicina de precisión y el abordaje del cáncer de próstata
En un ensayo de fase III presentado en el congreso también se observó un beneficio en la SSP en 182 pacientes no tratados previamente con terapia específica del sitio CUP guiada por un ensayo de expresión de 90 genes versus quimioterapia empírica (Resumen 1208MO).
La mediana de SSP fue de 9,6 meses con terapia específica del sitio versus 6,6 meses con quimioterapia empírica (HR 0,68; IC 95 % 0,49–0,93; p = 0,017) en una mediana de seguimiento de 42,9 meses. La mediana de SG fue más larga con la terapia específica del sitio que con la terapia empírica (28,2 meses versus 19,0 meses, respectivamente; HR 0,74; IC 95 % 0,52–1,06; p = 0,098) y los eventos adversos de grado ≥3 fueron similares en ambos brazos. Michielin afirma que «este es un ensayo interesante que muestra aún más la importancia de identificar el sitio del tumor primario para permitir el uso de regímenes de quimioterapia específicos de órganos. Sin embargo, como se vio en el ensayo CUPISCO, las tasas de supervivencia aún eran bajas, lo que pone de relieve que aún quedan considerables necesidades insatisfechas».
Perfiles genómicos
En cuanto al diagnóstico, los datos presentados por el estudio CUP-ONE de 418 muestras revelaron una precisión similar cuando se utilizaron los datos de la firma de expresión genética de 92 genes CancerTYPE ID (CTID) frente a la inmunohistoquímica centralizada especializada (C-IHC; 11 marcadores) en comparación con un equipo multidisciplinario de determinado diagnóstico de referencia, aunque CTID mostró mayor precisión para clasificar el colangiocarcinoma (LBA100). Según Michielin, «el rendimiento de CTID parece ser similar al de C-IHC, salvo en el colangiocarcinoma, un tumor relativamente raro. Definir el diagnóstico de referencia estándar de oro sigue siendo un desafío en tales estudios, pero hay que seguir desarrollando herramientas para mejorar la precisión del diagnóstico».
Reflexionando sobre el cambiante panorama general de la gestión de CUP, Michielin dice: «La elaboración de perfiles genómicos es cada vez más frecuente debido a la mayor presencia de programas de oncología de precisión y juntas de tumores moleculares. Los ensayos en curso en CUP, que incluyen perfiles de tejido y sangre, pueden permitir nuevas estrategias terapéuticas, incluidas terapias dirigidas e inmunoterapias, para mejorar más los resultados».
Referencia
Mileshkin T, Bochtler C, Pauli G, Durán-Pacheco C, Arslan F, Bigot N. LBA16 Primary analysis of efficacy and safety in the CUPISCO trial: A randomised, global study of targeted therapy or cancer immunotherapy guided by comprehensive genomic profiling (CGP) vs platinum-based chemotherapy (CTX) in newly diagnosed, unfavourable cancer of unknown primary (CUP). Annals of Oncology[Internet].2023[citado 23 oct 2023]; 34(supl 2): S1254-S1255. https://doi.org/10.1016/j.annonc.2023.10.006.
24 octubre 2023| Fuente: Diario Médico| Tomado de Medicina| Oncología
oct
24
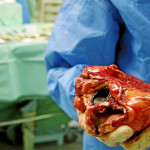 Lawrence Faucette se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo y, un mes después, no muestra señales de que su cuerpo rechace el órgano.
Lawrence Faucette se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo y, un mes después, no muestra señales de que su cuerpo rechace el órgano.
Ha pasado un mes desde que un hombre de Maryland se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo, y un video del hospital difundido el viernes lo muestra trabajando duro para reponerse.
Lawrence Faucette estaba a punto de morir por insuficiencia cardiaca y no era elegible para un trasplante de corazón tradicional debido a otras complicaciones de salud cuando los médicos de la Facultad de Medicina de la Universidad de Maryland le ofrecieron esa cirugía altamente experimental.
En las primeras imágenes de Faucette desde el trasplante del 20 de septiembre, un video del hospital muestra al fisioterapeuta Chris Wells instándole a sonreír mientras pedalea para recuperar fuerzas.
“Va a estar difícil, pero triunfaré», contesta Faucette, de 58 años, resoplando pero esbozando una sonrisa.
El equipo de Maryland realizó el año pasado el primer trasplante mundial de un corazón de un cerdo genéticamente modificado a otro hombre moribundo.
David Bennett sobrevivió solamente dos meses antes de que ese corazón dejara de funcionar por razones que no están completamente claras, aunque más tarde se encontraron evidencias de un virus porcino en el interior del órgano.
Lo aprendido en aquel primer experimento produjo varios cambios antes de este segundo intento, entre ellos la mejora de las pruebas de detección de virus.
Los intentos de trasplante de órganos de animales a humanos —los llamados xenotrasplantes— han fracasado durante décadas, ya que el sistema inmunitario de las personas destruía de inmediato el tejido extraño. Ahora los científicos vuelven a intentarlo con cerdos modificados genéticamente para que sus órganos sean más parecidos a los humanos.
En el video del hospital difundido el viernes, los médicos de Faucette dijeron que el corazón de cerdo no ha presentado síntomas de rechazo.
“Su corazón está haciendo todo autónomamente”, dijo el doctor Muhammad Mohiuddin, jefe de xenotrasplantes cardiacos del equipo de Maryland.
Una vocera del hospital dijo que Faucette, de Frederick, Maryland, ha podido levantarse y que los fisioterapeutas lo están ayudando a ganar las fuerzas necesarias para intentar caminar.
Muchos científicos esperan que algún día los xenotrasplantes puedan compensar la enorme carencia de donaciones de órganos humanos. Más de 100 mil personas están en la lista de trasplantes de Estados Unidos, la mayoría a la espera de un trasplante de riñón, y miles morirán esperando.
Un puñado de equipos científicos han probado riñones y corazones de cerdos en monos y en cuerpos humanos donados, esperando aprender lo suficiente para que la Administración de Alimentos y Medicamentos de Estados Unidos les permita realizar estudios formales de xenotrasplantes.
24 octubre 2023| Fuente: Proceso| Tomado de Noticias Medicina | Ciencia -Tecnología
oct
3
 El Nobel de Medicina ha distinguido este lunes a la húngara Katalin Karikó y al estadounidense Drew Weissman por sentar las bases para el desarrollo de las vacunas con ARN mensajero (ARNm) contra el Covid-19 y otras enfermedades infecciosas.
El Nobel de Medicina ha distinguido este lunes a la húngara Katalin Karikó y al estadounidense Drew Weissman por sentar las bases para el desarrollo de las vacunas con ARN mensajero (ARNm) contra el Covid-19 y otras enfermedades infecciosas.
Sus investigaciones no solo alteraron la comprensión de “cómo el ARN mensajero interactúa con nuestro sistema inmune”, sino que fueron “cruciales” para obtener vacunas efectivas a un ritmo “sin precedentes” durante “una de las grandes amenazas a la salud humana en tiempos modernos”, destacó la Asamblea Nobel del Instituto Karolinska de Estocolmo.
Los descubrimientos sobre las modificaciones de las bases de nucleósidos logrados por ambos investigadores podrían ser usados además en el futuro para tratar ciertos tipos de cáncer y producir proteínas terapéuticas.
La presidenta del comité nobel de Medicina, Gunilla Carlsson indicó, en la rueda de prensa posterior al anuncio del premio, que el éxito de las vacunas contra Covid-19 han tenido una enorme repercusión en el interés de las tecnologías basadas en ARNm.
Entre las aplicaciones enumeró nuevas vacunas contra otros virus, como el de la gripe, esta tecnología es una plataforma “rápida y flexible” para realizarlas.
Además, se investiga en vacunas terapéuticas para el cáncer, ya sea de manera personalizada o más general, y existen ensayos clínicos para administrar proteínas terapéuticas. “Hay mucho trabajo que veremos en el futuro”, dijo Carlsson.
El fallo resalta que durante mucho tiempo ha habido vacunas basadas en virus muertos o debilitados, pero que no fue hasta décadas recientes, gracias a los progresos en biología molecular, que se empezaron a probar otras a partir de componentes virales individuales.
Usando el código genético viral se han obtenido así vacunas contra la hepatitis B o el ébola.
El hecho de que la producción de vacunas basadas en virus, proteínas o vectores requiera cultivo celular a gran escala, lo que limita la producción en caso de brotes o pandemias, ha impulsado durante tiempo a los científicos a buscar tecnologías de vacunas independientes de este.
En la década de 1980 se introdujeron métodos eficientes para producir ARNm sin cultivo celular, denominados transcripción in vitro, pero su inestabilidad, las dificultades para producirlo y que causase reacciones inflamatorias limitó sus aplicaciones clínicas.
Mientras trabajaban en la Universidad de Pensilvania (EUA), Karikó y Weissman, que compartían su interés por el uso terapéutico del ARNm, empezaron a colaborar en las diferentes formas de interacción de este con el sistema inmune.
Descubrieron que las células dendríticas -importantes en la vigilancia inmunitaria y la activación de respuestas inmunológicas inducidas por vacunas- reconocían ARNm transcrito in vitro como una sustancia extraña que las activaba y liberaba moléculas de señalización inflamatorias.
En una investigación publicada en 2005 revelaron que la respuesta inflamatoria era prácticamente eliminada cuando se incluían modificaciones de base en el ARNm y, en otros estudios posteriores, que la producción de proteínas aumentaba de forma notable, lo que eliminaba “obstáculos críticos” en sus aplicaciones terapéuticas.
Varias compañías comenzaron a trabajar a partir de 2010 usando ese método para producir primero vacunas contra el virus Zika y el MERS-CoV, y años más tarde, con la pandemia de Covid-19 contra el SARS-CoV-2, lo que permitió tener vacunas efectivas contra este a finales de 2020.
“Las vacunas han salvado millones de vidas y prevenido enfermedades severas en muchas más, permitiendo a las sociedades abrir y regresar a condiciones normales”, explica el Karolinska.
Nacida en Szolnok (Hungría) en 1955, Karikó se formó en su país antes de ampliar estudios a finales de la década de 1980 en Estados Unidos, donde ejerció la docencia en la Universidad de Pensilvania hasta 2013, para pasar luego a ocupar puestos dirigentes en la farmacéutica BioNTech, una de las productoras de vacunas contra el Covid-19.
El secretario del Comité del Nobel de Medicina Thomas Perlmann, encargado de comunicar el galardón por teléfono a los elegidos, dijo que ambos estaban abrumados y agradecidos
Pelmann destacó la figura de Karikó, “una científica extraordinaria e inusual” a la que apasionó la idea del ARNm y su uso terapéutico, y que “resistió cualquier tentación de alejarse de ese camino y hacer algo quizás más fácil”.
Weissman (Lexington, EUA, 1959) se especializó en bioquímica y enzimología en la Universidad Brandeis y continuó su labor científica en la Universidad de Boston, los Institutos Nacionales de Salud y en la Universidad de Pensilvania, donde comenzó a trabajar con Karikó en el estudio del ARN y el sistema inmunitario innato.
Ambos han recibido premios como el Princesa de Asturias de Investigación Científica y Técnica (2021), así como el Premio Rosenstiel (EUA) en 2020.
Los premiados suceden en el palmarés del Nobel de Medicina al sueco Svante Pääbo, galardonado el año pasado por sus descubrimientos sobre el genoma de homínidos extinguidos y la evolución humana.
Karikó, que también tiene nacionalidad estadounidense, es la primera húngara en ganar un Nobel y la décimo tercera mujer en recibir el de Medicina, de un total de 227 galardonados desde 1901.
Ambos compartirán 997 mil dólares con que están dotados este año todos los Nobel.
La ronda de ganadores continuará mañana con el premio de Física, al que seguirán, en los próximos días, los de Química, Literatura, de la Paz y Economía.
Referencia
Karikó K, Weissman D. The Nobel Prize in Physiology or Medicine 2023. Press Release.
3 octubre 2023 | Fuente: el Comentario |Tomado de Ciencia y Salud
sep
23
 La identificación de nuevos genes relacionados con la resistencia quimioterapia en pacientes con carcinoma de células escamosas de cabeza y cuello (CECyC) abre nuevas vías para la medicina de precisión en este tipo de cáncer.
La identificación de nuevos genes relacionados con la resistencia quimioterapia en pacientes con carcinoma de células escamosas de cabeza y cuello (CECyC) abre nuevas vías para la medicina de precisión en este tipo de cáncer.
El cáncer de cabeza y cuello (CECyC) engloba un grupo de cánceres que se forman en los tejidos del tracto digestivo superior o en los senos y cavidad nasal. La mayoría derivan de las células escamosas que forman estos tejidos, de donde reciben su nombre.
Cuando el CECyC no está muy avanzado existen opciones de tratamiento efectivas con una elevada tasa de supervivencia a cinco años. En el caso de enfermedad avanzada, sin embargo, existen menos oportunidades de tratamiento. Una de las causas de esta situación es que todavía se desconoce en gran medida la variabilidad genética del CECyC. Como resultado, todos los pacientes reciben un tratamiento similar sin tener en cuenta el perfil genético de su cáncer. No existen opciones de tratamientos de precisión que permitan definir el mejor tratamiento para el tumor de cada paciente y, en muchos casos, las combinaciones de quimioterapia estándar derivan en toxicidad o resistencia al tratamiento.
Con el objetivo de mejorar esta situación, investigadores de la Universidad Queen Mary de Londres han utilizado diferentes aproximaciones bioinformáticas y genéticas dirigidas a identificar genes que puedan estar relacionados con la enfermedad y permitan clasificar mejor a los pacientes. Los resultados apuntan a dos nuevos genes de interés y dos moléculas con potencial terapéutico.
“Estos resultados son un paso prometedor para que en el futuro los pacientes de cáncer reciban un tratamiento personalizado basado en sus genes y su tipo de tumor que les proporcione una mejor tasa de supervivencia y mejores resultados terapéuticos”, ha señalado Muy-Teck Teh, investigador en la Universidad Queen Mary de Londres y uno de los responsables del estudio.
Identificando los genes que confieren resistencia a la quimioterapia en carcinoma escamoso de cabeza y cuello
En primer lugar, los investigadores utilizaron minería de datos para identificar genes que se expresan de forma diferente en muestras sanas y tumorales de pacientes con CECyC. De esta forma identificaron 40 genes candidatos.
A continuación, el equipo analizó la expresión de los 40 genes seleccionados en ocho líneas de células orales, así como en 10 líneas de CECyC. De esta forma, acotaron el número de candidatos a 28 genes con expresión diferencial entre células normales y células tumorales. Los candidatos, además, participan en procesos relacionados con el cáncer, como la modulación del sistema inmunitario o la proliferación.
Por último, el equipo evaluó en diferentes experimentos qué genes de los que mostraban diferente actividad podían influir en la resistencia a la quimioterapia en el CECyC. En este paso identificaron 10 genes relacionados, y seleccionaron los cuatro más significativos (TOP2A, DNMT1, INHBA y NEK2) para realizar estudios más detallados.
Finalmente, a partir de ensayos más precisos con los cuatro genes más prometedores, los investigadores concluyen que la expresión de NEK2 confiere quimioresistencia al cisplatino, al 5-fluorouracilo, al paclitaxel, y al docetaxel. Por otra parte, los genes INHBA y TOP2A confieren la resistencia a la mayoría de líneas celulares resistentes a fármacos. Y en cuanto a DNMT1, los investigadores señalan que ejerce efectos heterogéneos en cuanto a la quimiorresistencia.
Nuevas perspectivas para hacer frente a la resistencia a la quimioterapia
Una vez identificados los genes cuya activación está relacionada con la resistencia a los multitratamientos que se utilizan para hacer frente al CECyC, el siguiente paso de los investigadores fue identificar fármacos o sustancias que pudieran regular su actividad.
El equipo utilizó una librería de fármacos para rastrear posibles interacciones fármaco-gen y encontró dos compuestos de origen natural muy interesantes. Tanto la Sirodesmina A, de origen fúngico, como el fármaco anticáncer Carfilzomib, bloquean la expresión de NEK2 e INHBA y devuelven la sensibilidad al cisplatino a las células resistentes.
Los investigadores plantean que tanto la Sirodesmina A como el Carfilzomib podrían reposicionarse para contrarrestar la resistencia al cisplatino en tumores con expresión elevada de NEK2 y/o INHBA.
Resultados prometedores para la medicina de precisión
El trabajo identifica dos genes relacionados con la resistencia al tratamiento en el CECyC, cuya expresión podría servir para clasificar mejor a los pacientes. Además, también presenta dos compuestos que podrían ayudar a hacer frente a la aparición de resistencias.
Estudios futuros deberán investigar en mayor detalle las interacciones entre la Sirodesmina A y el Carfilzomib y los genes NEK2 y INHBA, así como su potencial en un entorno clínico.
“Por desgracia, hay muchas personas que no responden a la quimioterapia ni a la radioterapia”, indica Muy-Teck Teh, investigador en la Universidad Queen Mary de Londres y director del estudio. “Pero nuestro estudio ha demostrado que, al menos en los cánceres de cabeza y cuello, son estos dos genes concretos los que podrían estar detrás de esta situación, y que se pueden atacar para luchar contra la quimiorresistencia”.
Referencia científica
Khera N, Soodhalaagunta Rajkumar A, Abdulkader M Alkurdi K, Liu Z, Ma H, et al. Identification of multidrug chemoresistant genes in head and neck squamous cell carcinoma cells. Mol Cancer. 2023; 146. doi: http://dx.doi.org/10.1186/s12943-023-01846-3
19/09/2023
Fuente: (genotipia) Tomado de Noticias Genética Médica News
Copyright 2023 © Genotipia
ago
31
 El Biobanco del CNIO alberga más de 43.000 muestras humanas, sin las que sería imposible diseñar tratamientos cada vez más personalizados o mejorar el diagnóstico precoz.
El Biobanco del CNIO alberga más de 43.000 muestras humanas, sin las que sería imposible diseñar tratamientos cada vez más personalizados o mejorar el diagnóstico precoz.
Con mucho cuidado, entre el humo del nitrógeno líquido, Eva Ortega saca un pequeño contenedor de un arcón congelador. El recipiente contiene células humanas, linfocitos criopreservados con mimo para que su vida quede suspendida, a la espera de que alguien las necesite. «Ahora mismo es como si estuvieran dormido», explica la investigadora. «Protegidos e inmortalizados para garantizar que cuando se descongelen sean viables para hacer cultivos en el laboratorio».
El Biobanco del Centro Nacional de Investigaciones Oncológicas (CNIO), en Madrid, alberga más de 43.000 muestras humanas que, como esas células, son fundamentales para la investigación. En las instalaciones del centro se almacenan tejidos y sustancias como tumores, uñas, sangre, orina, heces o saliva que ya están siendo fundamentales para el avance de la medicina. Aunque no lo parezca, son un verdadero tesoro biológico para la ciencia.
«Sin la información que proporcionan estas muestras sería imposible diseñar tratamientos que cada vez son más personalizados o mejorar el diagnóstico precoz de enfermedades como el cáncer», señala Ortega, directora científica del organismo, que fue pionero en la creación de una red de tumores en España.
«En investigación básica y preclínica, las muestras humanas son imprescindibles para el desarrollo de infinidad de aplicaciones. Desde biomarcadores o indicadores de pronóstico a dianas terapéuticas», continúa la investigadora. Mientras habla, muestra otro arcón congelador que alberga xenoinjertos derivados de pacientes; biopsias de tumores humanos que se implantan en ratones u otros animales para su desarrollo y posterior estudio. «Hay más de 200 modelos de todo tipo de cánceres: páncreas, colon, pulmón, ovario… Y todos ellos están en régimen de biobanco», lo que significa que están disponibles para los investigadores que las necesiten. «Los biobancos son para los tejidos lo que las bibliotecas son para los libros», subraya Ortega, a quien le gustaría que, en lugar de biobancos, estos centros se denominasen biotecas.
Custodia, ética y legalidad
La custodia de sus recursos es fundamental. Para que las muestras puedan ser útiles para la investigación, es clave «mantener altísimos niveles de calidad» tanto en la extracción y procesamiento de esos tejidos como en su posterior almacenamiento, subraya Ortega. Por eso, el xenoinjerto que acaban de sacar de un congelador en el que estaba a -80 grados va directamente a un recipiente con nieve carbónica. «No queremos que en ningún momento haya una fractura en la cadena del frío, porque, si esto sucediera, puede variar la calidad de la muestra. Si se alteran las variables preanalíticas estás cambiando la muestra antes de analizarla», explica Ortega. Y eso supone que ya no sea útil para la investigación.
«En un biobanco no se puede improvisar». Todo está estrictamente protocolarizado y estandarizado para garantizar la calidad y la seguridad de los procesos. «No hay cabida para la espontaneidad ni el azar. Seguimos procedimientos normalizados y también utilizamos una semántica común a nivel internacional».
Además de directora científica del Biobanco del CNIO, Ortega también coordina el área de biobancos de la plataforma nacional de Biobancos y Biomodelos del Instituto de Salud Carlos III y es la coordinadora científica del Nodo Nacional que representa a España en el Consorcio Europeo de Biobancos (BBMRI-ERIC), que aglutina a más de 700 biobancos.
Debido a esta interconexión, científicos de otros países y también de otros puntos del país pueden tener acceso a las muestras almacenadas en el biobanco -y también al contrario-, «siempre que cumplan los requisitos científicos y éticos exigibles por la legislación».
«El respeto a las disposiciones legales y éticas que protegen los derechos de los donantes» es, junto a la calidad de las muestras y los datos que se manejan, otro de los pilares del biobanco, subraya la científica.
Por ejemplo, se garantiza que los datos personales de quien ha donado tejido sean confidenciales, de forma que las muestras y los datos clínicos siempre se ceden de forma anónima. Del mismo modo, también se certifica que todas las muestras se usen únicamente en proyectos de investigación que hayan sido previamente aprobados por un comité científico y un comité de ética, y solo se admiten donaciones si la persona ha firmado previamente un consentimiento informado.
Los aspectos éticos son fundamentales, porque en el pasado se cometieron abusos que no se pueden repetir, señala la investigadora. «Uno de los casos más flagrantes de mal uso de muestras a nivel ético fue el caso de la línea celular HeLa», remarca.
HeLa es el acrónimo de Henrietta Lacks, una mujer afroamericana de 31 años que, en 1951, murió de cáncer de cuello de útero. Sin su consentimiento, los médicos que la atendieron en Baltimore (EEUU) tomaron una biopsia de su tumor y la compartieron con George Otto Gey, un investigador del cáncer que, enseguida y para su asombro, comprobó la enorme capacidad que tenían aquellas células para replicarse en cultivos de laboratorio. Desde entonces, estas células se han utilizado en más de 70.000 estudios y han sido claves para muchísimos avances, como los que condujeron a la vacuna de la polio. Pero también son un paradigma de mala praxis. Tras años de silencio, recientemente, la empresa ThermoFisher, que comercializó las células de Lacks sin permiso, ha accedido a compensar económicamente a sus descendientes. «Los principios éticos basados en el consentimiento de los pacientes son fundamentales y deben respetarse siempre», incide Ortega.
- Los biobancos españoles buscan cómo encajar en la estructura europea
- La gestión de biobancos precisa revisión normativa
- Así funciona el banco de cerebros más avanzado: «Los guardamos para siempre. Nunca se tiran»
La información que puede extraerse de las muestras es cada vez más extensa y variada, señala la investigadora. Por tanto, se intentan optimizar al máximo las posibilidades de conservación. Para que no se pierda nada.»Cuando existe la opción, intentamos preservar el tejido de diferentes formas», apunta María Jesús Artiga, responsable del área operativa del biobanco del CNIO. Así, por ejemplo, cuando llega un tumor al centro se intenta congelar una parte y conservar fijado en parafina el resto. «La fijación se hace inmediatamente después de que el patólogo haya hecho la valoración de qué tipo de tejido es y cuál es el diagnóstico. Esta fijación permite preservarlo, pero también se pierden propiedades y no permite el análisis de algunos aspectos, como el ARN, porque en el proceso se degrada. Sin embargo, si mantienes parte de la muestra congelada, puedes obtener esos datos que faltan. Es una manera de complementar la información que puedes obtener buscando distintos formatos de preservación», aclara Artiga.
«La información que puede extraerse de las muestras es infinita», añade Ortega, al abrir una de las salas del biobanco. «Aunque la muestra se agote, la información que se genera ya ha quedado para la comunidad científica y, en el futuro, seguirá proporcionando datos útiles para generar conocimiento», subraya.
Renacer
Una de las particularidades de este biobanco es que alberga las muestras de la Red Nacional de Metástasis Cerebral (Renacer), la primera colección de muestras vivas humanas de metástasis cerebral en todo el mundo. «Decimos que es una cohorte viva porque mantenemos la muestra como si siguiera viviendo, en unas condiciones y a una temperatura reguladas», señala la investigadora.
Renacer, creada en 2021 por el Grupo de Metástasis Cerebral y el Biobanco del CNIO, pretende crear una colección de muestras humanas para impulsar la investigación de las metástasis cerebrales, un área todavía muy desconocida.
«La metástasis cerebral aparece en hasta el 30% de los tumores primarios, principalmente en el caso de los de pulmón, mama y melanoma, sin que todavía sepamos muy bien las causas», explica Ortega. «No se conocen los mecanismos que explican por qué, en algunos casos, las células tumorales son capaces de atravesar la barrera hematoencefálica y encontrar un nicho en el cerebro. Es algo que todavía no se ha descifrado».
El objetivo del grupo es contribuir a averiguarlo. Y para ello cuentan ya con más de 150 donaciones de tejidos cerebrales y la colaboración de 20 hospitales que pronto prevén ampliar a más centros. «La red ya ha permitido poner en marcha ensayos clínicos relacionados con la eficacia de la radioterapia frente a la metástasis en el cerebro y es un modelo por el que se han interesado distintos grupos de investigación», añade.
Muestras de personas sanas
El Biobanco también alberga una colección de muestras aportada por la Asociación Española de Tripulantes de Cabina de Pasajeros. Periódicamente, esta cohorte aporta muestras de sangre, suero, saliva, orina, heces y uñas que, entre otras cuestiones, se está utilizando para estudiar los efectos del jet lag en las células del sistema inmunitario. Según explican Ortega y Artiga, el trabajo explorará si en la sangre se pueden detectar marcadores de células inmunitarias que puedan ser útiles para identificar alteraciones en el ritmo circadiano que predispongan a desarrollar enfermedades inflamatorias, como el cáncer. «El objetivo es estudiar si estas personas, que realizan a menudo vuelos de largo recorrido, en los que salen por la mañana de un país y llegan al destino cuando es de nuevo por la mañana, pueden ser más vulnerables y tener mayor incidencia de cáncer», aclara Ortega. La investigación tendrá una duración de cuatro años.
Además, esas muestras también pueden ser útiles para otro tipo de análisis. «Por ejemplo, con las muestras de saliva se pueden hacer estudios sobre microbioma o para medir los niveles de cortisol, una hormona relacionada con el estrés», señala Artiga.
Las donaciones de personas a priori sanas, sin problemas de salud declarados, como la de esa cohorte, son muy apreciadas, porque escasean. «Las personas que están sufriendo una enfermedad están muy comprometidas con la investigación y quieren colaborar en todo lo posible con los avances científicos. Pero para los estudios también son fundamentales las donaciones de personas sanas», señala Ortega, quien anima a todas las personas interesadas en donar a ponerse en contacto con el centro. De cualquier manera, la investigadora explica que existen limitaciones que hay que considerar. «Es fundamental tener en cuenta la sostenibilidad de los biobancos. No podemos almacenar muestras y muestras sin un fin claro, porque con eso lo único que conseguiríamos es provocar un consumo que no revierte en un círculo virtuoso. Todo debe estar planificado», recuerda.
Las muestras almacenadas en el centro madrileño han permitido en muchas ocasiones generar conocimiento científico. «Durante la pandemia, por ejemplo, hubo un proceso colaborativo extremo, en el que se aunaron fuerzas a distintos niveles. Nosotros aquí recogimos muestras de covid que se compartieron, bajo consentimiento informado, tanto a nivel nacional como a nivel europeo. Y de esos datos han salido artículos científicos, por ejemplo, sobre la gravedad en función de variables de género», señala.
Detrás de cada una de las decenas de miles de muestras que se conservan en el centro madrileño «hay puestas muchas esperanza», reflexiona Ortega. «A cambio de las donaciones que los pacientes dan desinteresadamente nosotros debemos darles respuestas, un conocimiento alcanzado gracias a esas muestras de sangre, tejido tumoral, orina, heces o saliva que son imprescindibles para hacer avanzar la investigación científica».
Referencia
El biobanco del Centro Nacional de Investigaciones Oncológicas. https://www.cnio.es/investigacion-e-innovacion/servicios/biobanco/
29/08/2023 (Diario Médico) Tomado- Medicina Oncología © junio 2018 Unidad Editorial Revistas, S.L.U.
nov
8
El Centro de Educación Natural, en cooperación con Sporting Republic, organizó el maratón “Correr por la vida salvajes – Animales silvestres no son medicina” en el área urbana Ciputra, en Hanoi. Read more

