abr
22
 El hábito tabáquico puede producir problemas lumbares y cervicales, ya que «afecta el flujo sanguíneo; agrava el daño estructural en las vértebras; contribuye a la degeneración de los huesos» y «afecta las raíces nerviosas, incrementando el riesgo de dolor radicular y ciática», según explica la jefa de la Unidad del Dolor del Hospital Universitario Sanitas Virgen del Mar, Eva Mercado.
El hábito tabáquico puede producir problemas lumbares y cervicales, ya que «afecta el flujo sanguíneo; agrava el daño estructural en las vértebras; contribuye a la degeneración de los huesos» y «afecta las raíces nerviosas, incrementando el riesgo de dolor radicular y ciática», según explica la jefa de la Unidad del Dolor del Hospital Universitario Sanitas Virgen del Mar, Eva Mercado.
Las molestias en la parte superior del cuerpo pueden tener orígenes muy diversos y son cada día más prevalentes. De hecho, según la Organización Mundial de la Salud (OMS), más de 500 millones de personsas en todo el mundo sufren dolor lumbar y unos 200 millones dolor de cuello.
En este sentido, existen varios factores que pueden provocar o agravar estos dolores, como el estrés, que aumenta la tensión muscular en cuello y hombros y está muy relacionado con el dolor cervical crónico, o el sedentarismo, que predispone al dolor cervical y lumbar.
«Por eso hay que realizar actividad física. Es muy necesario mantenerse activo. También previene el sobrepeso, que dificulta mantener una postura estable y, por tanto, puede conllevar la aparición de este tipo de dolor», añade la doctora Mercado.
«Otro consejo que daría es cuidar el calzado: un tacón no debe superar los tres centímetros y ha de ser lo suficientemente ancho para que el pie pueda tener el punto de apoyo necesario para no provocar desequilibrios», detalla la experta.
Asimismo, problemas como el bruxismo, la mala oclusión dental o la tensión en la mandíbula pueden desencadenar una serie de compensaciones musculares y posturales que afectan directamente a ambas zonas.
En este sentido, la odontóloga del Departamento de Innovación y Calidad Clínica de Sanitas Dental, Lorena Trinidad Bueno, asegura que «es trascendental mantener una postura adecuada al masticar y hablar. Estos hábitos, junto con cuidados dentales regulares que garanticen una salud oral óptima, promueven una columna vertebral más alineada y libre de molestias».
LA HIGIENE POSTURAL EN LA RUTINA DIARIA
A su vez, desde Sanitas precisan que otro aspecto que se suele olvidar, tan importante como el resto, es la higiene postural, que consiste en adoptar posiciones y movimientos que distribuyan correctamente el peso que debe soportar la columna vertebral para evitar lesiones.
«Si no se adoptan posturas óptimas en la rutina diaria, el daño puede derivar en lesiones como lumbalgias, cervicalgias, contracturas, tunel carpiano o epicondilitis, entre otras», apunta la doctora Mercado.
Para evitar estos problemas y fomentar una correcta higiene postural, desde Sanitas recomiendan que, en caso de dedicar muchas horas sentado delante del ordenador, se debe procurar que el ángulo de visión esté en línea recta con la pantalla y, así, evitar una inclinación innecesaria para el cuello.
Además, el tronco del cuerpo debe acercarse lo máximo posible al respaldo del asiento para evitar encorvarse. Con la espalda recta, el cuerpo adoptará un ángulo de 90° entre tronco y piernas.
También se deben apoyar los antebrazos, mantener los hombros relajados, no doblar las muñecas y que los pies alcancen a apoyarse totalmente en el suelo evitando que se queden colgando.
Al cargar peso, tanto para trabajos como para el día a día de cada persona, aconsejan distribuir el peso de forma simétrica. Para la espalda, es más recomendable usar un equipaje que utilice los dos hombros en vez de uno solo, como sería el ejemplo de una mochila en comparación con un bolso.
En el caso de levantar peso desde el suelo, lo idóneo es flexionar las rodillas mientras se mantiene la espalda lo más recta posible, evitando su inclinación. En cambio, si el peso a levantar se encuentra en una altura superior a la de los brazos estirados en línea recta, conviene utilizar algún elmento donde poder subirse y situarse a la misma altura.
Por último, al dormir, según la doctora Mercado, lo recomendable es adoptar una postura de lado, similar a la fetal. Para aquellos a los que les resulte incómoda esa postura, también se puede optar por dormir boca arriba situando un cojín debajo de las rodillas, aportando una ligera flexión de las piernas que elimina la lordosis lumbar.
En cualquier caso, la experta precisa que dormir boca abajo es «estrictamente desaconsejable» porque obliga a girar el cuello y la cabeza en algún sentido para poder respirar y puede provocar lesiones.
19 abril 2024|Fuente: Europa Press |Tomado de |Noticia
mar
19
 Las lesiones musculares son frecuentes en toda la población activa, y causan la mayoría de bajas de jugadores en el mundo del deporte. Según la gravedad, la recuperación de la función muscular es bastante lenta y puede requerir cirugía, medicación y rehabilitación. Ahora, un estudio liderado por la Universidad de Barcelona revela una estrategia para mejorar y acelerar la recuperación de lesiones musculares que tiene una aplicación potencial en el sector del deporte y la salud en general.
Las lesiones musculares son frecuentes en toda la población activa, y causan la mayoría de bajas de jugadores en el mundo del deporte. Según la gravedad, la recuperación de la función muscular es bastante lenta y puede requerir cirugía, medicación y rehabilitación. Ahora, un estudio liderado por la Universidad de Barcelona revela una estrategia para mejorar y acelerar la recuperación de lesiones musculares que tiene una aplicación potencial en el sector del deporte y la salud en general.
Este es el primer trabajo que aporta evidencias científicas sobre la recuperación más rápida y efectiva de las lesiones musculares a través de la exposición intermitente a una baja disponibilidad de oxígeno (hipoxia) en una cámara de baja presión barométrica (hipobárica) que simula las condiciones de gran altura geográfica.
El nuevo enfoque es importante para la recuperación de deportistas especialmente en la élite competitiva, pero también para paliar el impacto socioeconómico generado por las pérdidas de productividad laboral que causan estas lesiones en la población activa.
El estudio, llevado a cabo con modelos animales, se ha publicado en la revista Journal of Physiology. Los autores del trabajo son los expertos Garoa Santoildes, Teresa Pagès, Joan Ramon Torrella y Ginés Viscor, del Departamento de Biología Celular, Fisiología e Inmunología de la Facultad de Biología de la UB.
¿Por qué la hipoxia ayuda a regenerar el músculo lesionado?
Desde hace tiempo, las cámaras hipobáricas se usan para mejorar la condición física en deportes de alto rendimiento (alpinistas, escaladores, etc.) y en sectores profesionales (minería en altitud, observación astronómica, control fronterizo). En condiciones de hipoxia hipobárica, el cuerpo se expone a un ambiente de baja presión atmosférica en el que las células captan menos oxígeno y generan una respuesta fisiológica. Los efectos beneficiosos que causa la exposición a hipoxia intermitente en el cuerpo están bien descritos, pero todavía se exploran sus potenciales aplicaciones en biomedicina.
El estudio indica que cualquier tipo de lesión muscular podría recuperarse más rápidamente con sesiones de exposición intermitente a hipoxia hipobárica (altitud simulada), pero probablemente también las lesiones mio-tendinosas podrían acelerar su recuperación», apunta el catedrático Ginés Viscor, jefe del Grupo de Fisiología Adaptativa: Hipoxia, Ejercicio y Salud de la UB.
En los tejidos, la hipoxia provoca una activación local de la vía de HIF (el factor inducido por hipoxia), que es un sensor de los niveles de oxigenación. «Cuando la cantidad de oxígeno que llega a las células no es suficiente, la proteína HIF actúa como interruptor que activa una serie de cambios en tutas metabólicas para compensar este déficit», explica la profesora Garoa Santocildes.
Entre otras vías, la proteína HIF activa la proliferación de más vasos capilares a través del factor de crecimiento endotelial (VEGF), un proceso que aportaría a escala muscular más factores de crecimiento, substratos metabólicos y oxígeno que favorecen el proceso de regeneración muscular después de la lesión.
Tal como explica la profesora Teresa Pagès, «en paralelo, la proteína HIF también potenciaría la síntesis de proteínas concretas, la actividad de algunas enzimas y la eficiencia de las mitocondrias, que son los orgánulos celulares que subministran la energía para las funciones celulares».
Lesiones musculares y terapias: un cambio de paradigma
En el abordaje de las lesiones musculares, la visión clásica de la terapia RICE (en inglés, Rest, ice, compression and elevation) ha evolucionado hacia una visión más integral y activa, conocida como PEACE (Protection, elevation, avoid NSADs, compression, education) y LOVE (Load management, optimism, vascularization, exercise).
«Todo esto ha significado un gran cambio de paradigma en el ámbito de la recuperación de las lesiones musculares», detalla el profesor Joan Ramon Torrella. «La exposición a la hipoxia hipobárica —continúa el experto— es totalmente compatible con este nuevo paradigma, e incluso podría contribuir a mejorar los efectos de las terapias emergentes para acelerar la recuperación del músculo lesionado».
La terapia basada en la exposición en bajas concentraciones de oxígeno también podría ayudar a explorar nuevos tratamientos de lesiones fisiopatológicas. Así, sería importante comprobar si la hipoxia puede contrarrestar la atrofia muscular típica de la sarcopenia —una enfermedad caracterizada por la pérdida de masa y fuerza musculares— mediante los procesos implicados en la recuperación muscular (proliferación capilar, metabolismo oxidativo más efectivo, etc.).
«Muy probablemente, en estos casos, la intervención con hipoxia hipobárica mejoraría si se combina con actividades individualizadas de ejercicio físico de fuerza y resistencia. Incluso se podría mejorar su aplicación en la recuperación de afectados por el síndrome de covid persistente», concluye el equipo.
Ver artículo: Santocildes G, Viscor G, Pagés T, Ramon Torrella J. Simulated altitude is medicine: intermittent exposure to hypobaric hypoxia and cold accelerates injured skeletal muscle recovery. The Journal of Physiology[Internet].2023[citado 18 mar 2024].DOI10.1113/JP285398
18 marzo 2024|Fuente: EurekAlert | Tomado de |Comunicado de prensa
nov
3
 El agregado de vancomicina a la profilaxis con cefazolina no fue superior al placebo para prevenir infecciones quirúrgicas relacionadas con artroplastias en pacientes sin colonización conocida con Staphylococcus aureus resistente a la meticilina (SARM).
El agregado de vancomicina a la profilaxis con cefazolina no fue superior al placebo para prevenir infecciones quirúrgicas relacionadas con artroplastias en pacientes sin colonización conocida con Staphylococcus aureus resistente a la meticilina (SARM).
El trabajo Trial of Vancomycin and Cefazolin as Surgical Prophylaxis in Arthroplasty publicado por la revista The New England Journal of Medicine,evalúa si el agregado de un segundo antibiótico profiláctico es más efectivo que la monoterapia para prevenir las infecciones del sitio quirúrgico en los procedimientos de reemplazo articular.
Las infecciones del sitio quirúrgico después de una artroplastia tienen una elevada morbilidad y mortalidad y, además de representar un riesgo mayor para los pacientes y una elevada carga económica para el sistema de salud.
Las pautas actuales recomiendan la administración profiláctica de una cefalosporina de primera o segunda generación, como la cefazolina, en el momento de la artroplastia. Sin embargo, estos antibióticos no protegen contra las infecciones causadas por SARM u otros patógenos con patrones de resistencia similares.
Varios estudios sugirieron que el agregado de un segundo antibiótico glucopeptídico, como la vancomicina, amplía el espectro de actividad antimicrobiana aunque no demostraron sus beneficios de manera concluyente. Por este motivo, los autores evaluaron la eficacia de la adición de vancomicina a la profilaxis quirúrgica habitual con cefazolina para prevenir la infección del sitio quirúrgico en adultos sometidos a artroplastias.
Detalles de la investigación
La hipótesis fue encarada mediante un estudio multicéntrico de fase 4, doble ciego, de grupos paralelos, aleatorizado, controlado con placebo, en pacientes sin colonización conocida con SARM en quienes se realizaron procedimientos de artroplastia de cadera, rodilla u hombro.
Según las pautas vigentes en Australia, los pacientes sometidos a esas intervenciones reciben una profilaxis antimicrobiana quirúrgica con 2 g de cefazolina administrados por vía intravenosa (IV), 60 minutos antes de la incisión de la piel.
Tras una aleatorización en bloques, recibieron también 1,5 g de vancomicina IV (o 1 g en pacientes con pesos menores de 50 kg) o un placebo comparable en los 120 minutos previos a la incisión.
Además de los estudios prequirúrgicos habituales y de los procedimientos de descolonización, la investigación también examinó la portación perioperatoria de especies de estafilococos con hisopados de las fosas nasales y de la región inguinal antes de la administración del tratamiento profiláctico.
Después de la cirugía
El seguimiento continuó durante 180 días.
El criterio de valoración primario fue el desarrollo de una infección (superficial de la incisión, profunda o en un órgano u espacio) en cualquier sitio quirúrgico, evaluada a los 90 días de la intervención.
Como parámetros secundarios los autores evaluaron las infecciones producidas entre los 90 y los 180 días, las detectadas en el sitio quirúrgico y causadas por especies de estafilococos resistentes a la meticilina identificadas en los hisopados perioperatorios, así como el análisis de parámetros de seguridad que incluyeron variables de daño renal, reacciones de hipersensibilidad a los antimicrobianos y muerte por cualquier causa a los 180 días.
El estudio comprendió en total 4 113 pacientes: 2 044 recibieron vancomicina y 2 069, placebo, además de la profilaxis con cefazolina. Se detectó portación perioperatoria de Staphylococcus aureus en 29,1 %, con cepas sensibles a la meticilina en la mayoría de los casos.
Entre los patógenos resistentes, la tasa de SARM fue de 0,6 % y la de S. epidermidis resistente a meticilina, de 26,2 %.
Fueron detectadas infecciones en los sitios quirúrgicos en 4,5 % de los pacientes del grupo de vancomicina y en 3,5 % de los del grupo placebo, pero no se produjeron diferencias sustanciales en las infecciones de los distintos sitios quirúrgicos.
Se aisló un microorganismo o más en 51 pacientes (31 en los tratados con vancomicina y 19 en el grupo placebo). Todos los aislamientos de S. aureus excepto uno fueron sensibles a la meticilina; en 37 infecciones del grupo de vancomicina y en 5 del grupo placebo se identificaron bacilos gramnegativos.
El mismo microorganismo de la infección posoperatoria fue aislado en 19 pacientes que en los hisopados obtenidos previamente para detectar la portación de estafilococos.
Todos los casos se debieron a S. aureus meticilinosensibles.
Fallecieron 5 pacientes del grupo de vancomicina y 3 del grupo placebo. El daño renal agudo afectó alrededor del 2 % de los pacientes tratados con vancomicina y al 3,6 % de los del grupo placebo.
La investigación da cuenta de reacciones de hipersensibilidad en 1,2 % y 0,5 % de los pacientes tratados con vancomicina o placebo, respectivamente, con la inclusión de dos episodios de hipersensibilidad inmediata graves en pacientes tratados con vancomicina.
Resultados del trabajo
El estudio afirma que la adición de vancomicina no fue superior a la profilaxis antimicrobiana quirúrgica con cefazolina sola. El agregado de vancomicina se asoció con un riesgo más elevado de reacciones de hipersensibilidad y uno, más bajo, de daño renal.
Otros investigadores habían informado resultados variados en relación con la profilaxis con un segundo antibiótico glucopeptídico, aunque la selección del antibiótico y la implementación de diversos procedimientos para la prevención de infecciones podría haber influido en la variabilidad de los resultados.
En este estudio, los autores destacan que el S. aureus sensible a la meticilina fue el patógeno detectado con mayor frecuencia y sugieren que el hallazgo podría reflejar presiones de los antimicrobianos utilizados, con selección de variantes más virulentas de S. aureus o de bacterias gramnegativas en pacientes que recibieron la profilaxis combinada.
También advierten que la vancomicina se administró en los 120 minutos previos a la incisión de la piel, aunque otro estudio había sugerido que sería más efectiva cuando se administra 45 minutos antes de la incisión de la piel en el caso de las artroplastias.
Si bien se requieren más estudios para investigar los interrogantes planteados, los autores concluyen que en una población con baja tasa de colonización con SARM, el agregado de vancomicina no produjo mejores resultados que la profilaxis antimicrobiana quirúrgica habitual con una cefalosporina.
Referencia
Peel T, Astbury S, Nurs B, Cheng A, Biostat M, Paterson D, et al. Trial of Vancomycin and Cefazolin as Surgical Prophylaxis in Arthroplasty. N Engl J Med [Internet]. 2023[citado 2 nov 2023]; 389:1488-1498. DOI: 10.1056/NEJMoa2301401
2 noviembre 2023| Fuente: SIICSalud| Tomado de Noticias biomédicas
oct
25
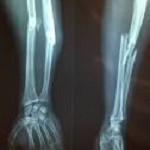 Los resultados de un ensayo de fase III confirman el valor de las células CD34+ de la médula ósea como nueva opción de tratamiento.
Los resultados de un ensayo de fase III confirman el valor de las células CD34+ de la médula ósea como nueva opción de tratamiento.
Investigadores de la Universidad de Kobe han demostrado que la inyección local de células CD34+ repara fracturas de fémur y tibia que no siguen el curso habitual de curación. El ensayo alcanzó su objetivo primario de cura radiológica a las 16 semanas en el 50 y en el 66% de los pacientes con fractura fémur y tibia, respectivamente, en comparación con controles históricos en los que no hubo ninguna cura completa de tibia en el mismo periodo de tiempo. Los científicos también constataron un incremento de los índices de unión, con desaparición de la línea de fractura, así como significativas mejoras en la calidad de vida relacionada con la salud, en algunos casos ya a las 24 semanas.
Takahiro Niikura, director del estudio, afirma que todos los efectos adversos asociados al procedimiento fueron leves o moderados y transitorios, ocurriendo principalmente durante la fase previa al trasplante celular. En el estudio los pacientes recibieron una dosificación diaria de G-CSF, citoquina que moviliza las células CD34+ desde la médula a la circulación. Esta población celular incluye progenitores endoteliales y células osteogénicas y puede ser extraída por leucoféresis y ulterior separación del resto de células mononucleares mediante un método magnético. Niikura señala que, hasta el momento, el tratamiento de este tipo de fracturas ha estado basado en la cirugía, combinada con la adición de aspirado de médula ósea o células madre mesenquimales (CMMs). Sin embargo, ningún enfoque previo había conseguido una tasa de cura del 100%, como la del actual ensayo. El científico concluye subrayando la superioridad de las células CD34+ frente a las CMMs, ya que sólo las primeras tendrían capacidad de generar los diversos tipos celulares necesarios para la reconstrucción del tejido óseo.
Kuroda R, Niikura T, Matsumoto T, Fukui T, Oe K, Mifune Y, et al. Phase III clinical trial of autologous CD34 + cell transplantation to accelerate fracture nonunion repair. BMC Med[Internet].2023[citado 23 oct 2023]; 21(386). https://doi.org/10.1186/s12916-023-03088-y
25 octubre 2023 | Fuente: IMMédico| Tomado de Noticia
may
21
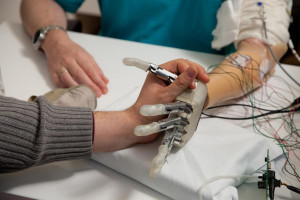
Recuperar todos los sentidos es uno de los grandes anhelos de las personas que pierden extremidad. Un hecho que se agudiza más en el caso de las manos. Sentir más allá del simple toque, lograr esa transmisión de sensaciones del roce de una mano con otra: un tacto biónico. «Es como tener una conexión con alguien. A mí me gustaría sentir las manos de mis dos hijos cuando voy por la calle con ellos, cogiéndoles de la mano. Eso sería bonito».
Roberto Renda es una amputado de Roma (Italia). Hace poco participó en un estudio para probar los efectos de la retroalimentación de temperatura directamente en la piel de su brazo residual. Él es uno de los 17 pacientes que han sentido cómo su mano fantasma experimentaba los cambios de temperatura gracias a la nueva tecnología de la Escuela Politécnica Federal de Lausana (EPFL).
«Lo que realmente me impresionó fue cuando Francesco [primer autor del trabajo] se colocó el sensor dactilar en el brazo en lugar de los materiales. Podía sentir la temperatura de su brazo. Era la primera vez en 20 años que podía sentir el calor de otra persona con mi mano fantasma. Sentía como si alguien estuviera tocando la mano que me faltaba», explica Roberto.
La revista Science publica los resultados del trabajo de Francesco Iberite, Jonathan Muheim, Silvestro Micera y Solaiman Shokur que se han afanado en incorporar nuevos estímulos sensoriales a las prótesis para proporcionar un tacto más realista a los amputados, y cuyo último estudio se centra en la temperatura. Llevan trabajando desde 2014 en diferentes características que van sumando a las prestaciones de las prótesis. «Fue sorprendente ver la reacción de los participantes cuando nos colocamos el sensor en la piel durante los experimentos: para ellos la sensación de calor era vívida, real, y cuando se dieron cuenta de que lo que sentían era contacto con otra persona, la emoción se veía en sus ojos», subraya Iberite.
¿Cómo funciona la prótesis?
Si se coloca algo caliente o frío en el antebrazo de una persona intacta, ésta sentirá la temperatura del objeto localmente, directamente en su antebrazo. Pero en los amputados, esa sensación de temperatura en el brazo residual puede percibirse en la mano fantasma que les falta. Sobre esto, Shokur, neuroingeniero científico senior de la EPFL que codirigió el estudio, apunta que «resulta importante que las sensaciones térmicas fantasma son percibidas por el paciente como similares a las experimentadas por su mano intacta».
Al proporcionar información sobre la temperatura de forma no invasiva, mediante electrodos térmicos (también conocidos como termodos) colocados sobre la piel del brazo residual, los amputados afirman sentir la temperatura en su miembro fantasma. Pueden experimentar si un objeto está frío o caliente y distinguir si tocan cobre, plástico o vidrio. Esta investigación es el resultado de una colaboración entre la EPFL, la Escuela de Estudios Avanzados Sant’Anna (SSSA) y el Centro Protesi Inail. La tecnología se probó con éxito en 17 de 27 pacientes.
«Cuando toco el muñón con la mano, siento un hormigueo en la mano que me falta, la mano fantasma. Pero sentir la variación de temperatura es otra cosa, algo importante… algo hermoso», apunta Francesca Rossi, paciente. La proyección de las sensaciones térmicas en el miembro fantasma ha llevado al desarrollo de una nueva tecnología biónica que dota a las prótesis de una retroalimentación térmica no invasiva que permite a los amputados discernir lo que están tocando.
Micera, de la Cátedra Fundación Bertarelli de Neuroingeniería Traslacional de la EPFL y profesor de la SSSA, recalca que «la retroalimentación de la temperatura es esencial para transmitir información que va más allá del tacto, conduce sentimientos de afecto. Somos seres sociales y el calor es una parte importante de ello».
¿Cómo es el actual prototipo: MiniTouch?
Para el estudio, Shokur y Micera desarrollaron el MiniTouch, un dispositivo que proporciona retroalimentación térmica y construido específicamente para su integración en dispositivos wearables como las prótesis. Ésta consiste en un sensor delgado y ponible que puede colocarse sobre el dedo protésico de una persona amputada. El sensor detecta información térmica sobre el objeto que se toca y, más concretamente, su conductividad térmica. Si el objeto es metálico, naturalmente conducirá más calor o frío que, por ejemplo, uno de plástico. Un termodo, que está en contacto con la piel del brazo residual del amputado, se calienta o enfría, transmitiendo al sensor dactilar el perfil de temperatura del objeto que se está tocando.
«Cuando presentamos la posibilidad de recuperar la sensación de temperatura en el miembro fantasma o de sentir el contacto con distintos materiales, obtuvimos muchas reacciones positivas. Y al final conseguimos reclutar a más de 25 voluntarios en menos de dos años», explica Federico Morosato, responsable de organizar el aspecto clínico de los ensayos en el Centro Protesi Inail.
Los científicos descubrieron que pequeñas zonas de piel del brazo residual se proyectan a partes específicas de la mano fantasma, como el pulgar o la punta del dedo índice. Como era de esperar, descubrieron que el mapeo de las sensaciones de temperatura entre el brazo residual y la totalidad de la mano fantasma proyectada es único para cada paciente.
«Nos centramos en las sensaciones térmicas porque creemos que es una de las claves para que la experiencia más realista: cada objeto que tocamos tiene una temperatura; si no la sentimos nos falta algo. Un aspecto muy interesante de nuestra técnica es su intuitividad: en poco en poco tiempo, incluso alguien totalmente novato en este tipo de estimulación eficazmente. Durante el experimento, los sujetos empezaron no sólo a distinguir objetos fríos y calientes, sino también a reconocer distintos materiales aprovechando sus diferencias de temperatura, lo que demuestra el potencial de este resultado», remacha Iberite.
Mayo 20/2023 (Diario Médico) – Tomado de Cirugía Ortopédica y Traumatología – Electrodos térmicos Copyright Junio 2018 Unidad Editorial Revistas, S.L.U.
may
21
La teragnosis fusiona el diagnóstico y la terapia. Un misil de precisión es la metáfora a la que suelen recurrir los expertos para referirse a ella porque permite realizar un diagnóstico molecular para estudiar la expresión de una determinada diana terapéutica de forma individual en cada paciente y posteriormente administrar un tratamiento personalizado dirigido contra esas dianas. En el campo de la oncología ya ha dado resultados muy positivos.
Ahora, un grupo gallego colaborativo de investigadores ha llevado la teragnosis por primera vez a la artritis reumatoide. El procedimiento ha sido probado con éxito en modelo animal, combinando en la misma prueba el diagnóstico y el tratamiento de manera personalizada. Las conclusiones de su trabajo se han publicado en la revista científica Journal Controlled Release, referencia mundial en sistemas de liberación controlada de fármacos.
La técnica consiste en un nuevo radiofármaco PET basado en nanopartículas que se inyecta de forma intra-articular en la rodilla y que aumenta significativamente la eficacia del tratamiento, porque permite que la molécula terapéutica, que es un péptido senolítico, permanezca más tiempo en el lugar de acción
Pablo Aguiar, del Grupo de Imagen Molecular del Centro Singular de Investigación en Medicina Molecular y Enfermedades Crónicas de la Universidad de Santiago de Compostela (Cimus) y María De la Fuente, del grupo de Nano-oncología del Instituto de Investigación Sanitaria de Santiago de Compostela (IDIS) han sido los coordinadores del estudio, en el que también han participado el grupo de María Mayán, del Instituto de Investigación Biomédica de A Coruña (Inibic).
Además, los hallazgos son el resultado de las investigaciones realizadas durante los dos últimos años por Sandra Díez-Villares y por Lara García-Varela, que combinaron sus perfiles complementarios en nanotecnología e imagen PET, respectivamente, para desarrollar con éxito una serie de experimentos de gran complejidad técnica.
Aproximación original
“Se trata de una aproximación que ya ha mostrado excelentes resultados en el campo de la oncología. Lo original es que ahora lo hemos desarrollado por primera vez para el tratamiento personalizado de la artritis”, enfatiza Pablo Aguiar.
Su grupo trabaja en imagen PET y el de María De la Fuente en nanofármacos. Por su parte, el equipo de María Mayán había desarrollado el péptido senolítico para artritis, que elimina las células senescentes. Aguiar explica cuáles son las principales innovaciones: “Una es que lo hemos nanoencapsualdo para que el tratamiento sea más efectivo porque permanece más tiempo en la rodilla, ya que normalmente los péptidos tienen un efecto limitado. La otra innovación principal es que lo hemos marcado radiactivamente para hacer la imagen PET”.
La idea es inyectar el radiofármaco al paciente de forma intraarticular en la rodilla. Los estudios de imagen PET desvelan si el fármaco está adherido a la articulación o si se ha liberado rápidamente, en cuyo caso el paciente no sería candidato al tratamiento.
Si el fármaco permanece en la rodilla, recibiría un tratamiento con una cantidad mayor del fármaco. “Es decir, el diagnóstico PET aporta la información necesaria para saber si el tratamiento va a ser efectivo o no, pues permite conocer la distribución y la cinética del fármaco antes de administrar el tratamiento”, aclara María De la Fuente.
El procedimiento ha dado resultados positivos en ratas y ahora es el momento de realizar un ensayo preclínico más amplio, también en modelo animal, para comprobar la respuesta terapéutica a la artritis reumatoide: “Conseguimos visualizar el fármaco y que permanezca más tiempo en su diana, ahora hay que verificar su efecto terapéutico”.
Mayo 21/2023 (Diario Médico) – Tomado de Medicina Nuclear – Péptido senolítico Copyright Junio 2018 Unidad Editorial Revistas, S.L.U.