jul
16
 La pobreza y las enfermedades mentales no solo están relacionadas, sino que también existe una relación causal, según un estudio de investigadores de la Universidad Médica de Ámsterdam, la Universidad de Edimburgo y la Universidad de Módena que demuestra que, si bien ciertos problemas de salud mental pueden obstaculizar la estabilidad financiera, la pobreza también es uno de los factores causales que conducen a los problemas de salud mental.
La pobreza y las enfermedades mentales no solo están relacionadas, sino que también existe una relación causal, según un estudio de investigadores de la Universidad Médica de Ámsterdam, la Universidad de Edimburgo y la Universidad de Módena que demuestra que, si bien ciertos problemas de salud mental pueden obstaculizar la estabilidad financiera, la pobreza también es uno de los factores causales que conducen a los problemas de salud mental.
«Este estudio indica que ciertos problemas de salud mental pueden hacer que la situación financiera de una persona sea incierta. Pero, a la inversa, también vemos que la pobreza puede conducir a problemas de salud mental», afirma el psiquiatra de Amsterdam UMC, Marco Boks.
Estudios anteriores han demostrado una fuerte correlación entre pobreza y enfermedad mental, pero es difícil desentrañar la relación causa-efecto. Las consecuencias de la enfermedad mental pueden afectar la situación financiera de una persona, por ejemplo, si esta no puede trabajar bien o tiene mayores costos de atención médica. Pero las circunstancias financieras difíciles también pueden causar problemas psicológicos.
Los investigadores del estudio, publicado en la revista Nature Human Behaviour, utilizaron datos del Biobanco del Reino Unido y del Consorcio Internacional de Genómica Psiquiátrica. «Descubrimos que la esquizofrenia y el TDAH contribuyen causalmente a la pobreza. A la inversa, la pobreza contribuye al trastorno depresivo mayor y a la esquizofrenia. El riesgo de anorexia nerviosa en realidad se reduce cuando hay pobreza», afirma Boks.
En primer lugar, se determinó una medida de pobreza en función de los ingresos familiares, los ingresos laborales y la privación social. A continuación, los investigadores utilizaron la información genética de los participantes mediante una técnica especial llamada aleatorización mendeliana para desentrañar la relación. La aleatorización mendeliana es un método para determinar la influencia de los factores de riesgo en una enfermedad, midiendo la variación de los genes que son más comunes en ciertos rasgos.
«Pudimos captar aspectos de la pobreza que comparten el individuo, el hogar y la zona en la que vive. Esto nos permitió identificar mejor los efectos causales de la pobreza en las enfermedades mentales», afirma el genetista estadístico de la Universidad de Edimburgo, David Hill.
Los resultados de esta investigación son importantes para la formulación de políticas y el enfoque de la pobreza y las enfermedades mentales. Al reconocer la influencia recíproca entre la pobreza y la salud mental, los responsables de las políticas pueden desarrollar intervenciones más eficaces destinadas a romper el ciclo de pobreza y problemas de salud mental. «La investigación proporciona pruebas sólidas de la necesidad de examinar también factores sociales como la pobreza, cuando se profundiza en el desarrollo de las enfermedades mentales», afirma Boks.
«Nuestros hallazgos sugieren que la reducción de las desigualdades podría conducir a ganancias sustanciales en la salud mental pública. A menudo existe confusión sobre el uso de datos genéticos para investigar la relación entre pobreza y enfermedad mental. Hacemos hincapié en que esto no significa que la pobreza sea genética. Al contrario, con los datos genéticos, pudimos identificar la pobreza como un factor ambiental modificable para la salud mental», añade la psiquiatra de la Universidad de Módena, Mattia Marchi.
15 julio 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
15
 Los primeros grupos humanos protagonizaron una historia de entremezclado e intercambio genético que sugiere una conexión mucho más íntima entre estos de lo establecido hasta ahora.
Los primeros grupos humanos protagonizaron una historia de entremezclado e intercambio genético que sugiere una conexión mucho más íntima entre estos de lo establecido hasta ahora.
Es el descubrimiento de un equipo internacional de genetistas y expertos en inteligencia artificial, bajo la dirección de Joshua Akey, profesor del Instituto Lewis-Sigler de Genómica Integrativa de Princeton.
«Esta es la primera vez que los genetistas han identificado múltiples oleadas de mezcla de humanos modernos y neandertales», dijo Liming Li, profesor del Departamento de Genética Médica y Biología del Desarrollo de la Universidad del Sudeste en Nanjing, China, quien realizó este trabajo como investigador asociado en el laboratorio de Akey.
«Ahora sabemos que durante la gran mayoría de la historia humana, hemos tenido una historia de contacto entre humanos modernos y neandertales», dijo Akey. Los homínidos que son nuestros antepasados más directos se separaron del árbol genealógico neandertal hace unos 600 000 años, y luego desarrollaron nuestras características físicas modernas hace unos 250 000 años.
«Desde entonces hasta que desaparecieron los neandertales, es decir, durante unos 200 000 años, los humanos modernos han estado interactuando con poblaciones neandertales», dijo.
Los resultados de su trabajo aparecen en la revista Science.
Los neandertales, que en el pasado se consideraban lentos y tontos, ahora son vistos como hábiles cazadores y fabricantes de herramientas que se curaban las heridas con técnicas sofisticadas y estaban bien adaptados para prosperar en el frío clima europeo.
Todos estos grupos de homínidos son humanos, pero para evitar decir «humanos neandertales», «humanos denisovanos» y «versiones antiguas de nuestra propia especie de humanos», la mayoría de los arqueólogos y antropólogos utilizan la abreviatura neandertales, denisovanos y humanos modernos.
Usando genomas de 2 000 humanos vivos, así como de tres neandertales y un denisovano, Akey y su equipo mapearon el flujo genético entre los grupos de homínidos durante el último cuarto de millón de años.
Los investigadores utilizaron una herramienta genética que diseñaron hace unos años llamada IBDmix, que utiliza técnicas de aprendizaje automático para decodificar el genoma. Los investigadores anteriores dependían de la comparación de genomas humanos con una «población de referencia» de humanos modernos que se creía que tenían poco o nada de ADN neandertal o denisovano.
El equipo de Akey ha establecido que incluso esos grupos de referencia, que viven a miles de kilómetros al sur de las cuevas neandertales, tienen trazas de ADN neandertal, probablemente llevado al sur por viajeros (o sus descendientes).
Con IBDmix, el equipo de Akey identificó una primera ola de contacto hace unos 200-250 000 años, otra ola hace 100-120 000 años y la más grande hace unos 50-60 000 años.
Eso contrasta marcadamente con datos genéticos anteriores. «Hasta la fecha, la mayoría de los datos genéticos sugieren que los humanos modernos evolucionaron en África hace 250 000 años, se quedaron allí durante los siguientes 200 000 años y luego decidieron dispersarse fuera de África hace 50 000 años y continuaron poblando el resto del mundo», dijo Akey.
«Nuestros modelos muestran que no hubo un largo período de estancamiento, sino que poco después de que aparecieran los humanos modernos, hemos estado migrando fuera de África y regresando a África también», dijo. «Para mí, esta historia trata sobre la dispersión, que los humanos modernos han estado moviéndose y encontrándose con neandertales y denisovanos mucho más de lo que reconocíamos anteriormente».
Esa visión de la humanidad en movimiento coincide con la investigación arqueológica y paleoantropológica que sugiere un intercambio cultural y de herramientas entre los grupos de homínidos.
La idea clave de Li y Akey fue buscar ADN de humanos modernos en los genomas de los neandertales, en lugar de lo contrario. «La gran mayoría del trabajo genético durante la última década se ha centrado realmente en cómo el apareamiento con los neandertales afectó a los fenotipos humanos modernos y a nuestra historia evolutiva, pero estas preguntas también son relevantes e interesantes en el caso inverso», dijo Akey.
Se dieron cuenta de que la descendencia de esas primeras oleadas de apareamientos entre neandertales y modernos debe haber permanecido con los neandertales, por lo que no dejó registro en los humanos vivos. «Como ahora podemos incorporar el componente neandertal a nuestros estudios genéticos, estamos viendo estas dispersiones anteriores de maneras que antes no podíamos», dijo Akey.
La última pieza del rompecabezas fue descubrir que la población neandertal era incluso más pequeña de lo que se creía anteriormente.
Los modelos genéticos han utilizado tradicionalmente la variación (diversidad) como un indicador del tamaño de la población. Cuanto más diversos son los genes, mayor es la población. Pero utilizando IBDmix, el equipo de Akey demostró que una cantidad significativa de esa aparente diversidad provenía de secuencias de ADN que se habían encontrado en los genomas de los neandertales.
12 julio 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
13
 Los efectos beneficiosos del ejercicio físico moderado son buenos para quienes lo practican, pero los investigadores han comprobado que sus beneficios redundan en los hijos y que se transmiten como herencia incluso hasta la segunda generación, los nietos.
Los efectos beneficiosos del ejercicio físico moderado son buenos para quienes lo practican, pero los investigadores han comprobado que sus beneficios redundan en los hijos y que se transmiten como herencia incluso hasta la segunda generación, los nietos.
Lo ha comprobado un equipo del Instituto Cajal del Consejo Superior de Investigaciones Científicas (CSIC) liderado por el investigador José Luis Trejo, que dirige el grupo «Estilo de Vida y cognición», y los resultados del trabajo se han publicado en el Journal of Neuroscience de la Sociedad Americana de Neurociencia.
Y al igual que los beneficios, los autores del trabajo han comprobado que los efectos adversos de un estilo de vida sedentario también repercuten sobre la descendencia a través de los mismos mecanismos.
Los investigadores han comprobado en ratones cómo el entrenamiento con ejercicio moderado tiene un efecto más duradero de lo que se pensaba, beneficiando hasta la segunda generación, y que muy probablemente está mediado por un pequeño grupo de «micro RNAs» que actúan transmitiéndose de padres a hijos a lo largo de las generaciones.
Esos «micro ARNs» (miRNAS), ha explicado el Instituto Cajal en una nota de prensa difundida hoy, son ARN (ácido ribonucleico) de pequeño tamaño que están involucrados en procesos fisiológicos que gobiernan la función cerebral normal y que son capaces de controlar la expresión génica, y constituyen un mecanismo epigenético de herencia que se transfieren a las siguientes generaciones a través de las células sexuales.
La herencia epigenética consiste en cambios en la función de los genes, inducidos por diversos mecanismos; esos cambios activan o inactivan genes sin modificar la secuencia del ADN, en respuesta a factores ambientales, como la alimentación o el ejercicio.
Ya se sabía que los «micro RNAs», que se descubrieron en 1993, están involucrados en procesos fisiológicos que gobiernan la función cerebral normal y los perfiles de «micro ARNs» desregulados se asocian con el desarrollo y la progresión de enfermedades neurodegenerativas como el alzhéimer.
Aunque no han estudiado este mecanismo en ratones hembra por la mayor dificultad para distinguir los efectos epigéneticos del ejercicio, los investigadores sí creen que un mecanismo similar funcionaría en las madres que hacen ejercicio, en las que los «micro RNAs» pasarían a sus óvulos.
Este hallazgo es relevante por la actual falta de pruebas que respalden la transmisión transgeneracional de los resultados positivos derivados de las intervenciones sobre el estilo de vida dirigidas al cerebro y la cognición, ha destacado el Instituto Cajal.
«Abordar esta cuestión es crucial, ya que podría proporcionar información valiosa para diseñar políticas de salud pública más impactantes ante el preocupante incremento del sedentarismo», ha manifestado José Luis Trejo Trejo.
Los investigadores encontraron también que no todos los efectos beneficiosos heredados por los hijos de los ratones físicamente activos se mantenían en los nietos, si sus padres eran sedentarios, lo que apunta a un desvanecimiento parcial de la influencia beneficiosa del ejercicio heredado de los abuelos cuando las siguientes generaciones abandonan la práctica de actividad física.
Los resultados de este trabajo, cuyas primeras autoras son Elisa Cintado y Patricia Tezanos, también podrían interpretarse como una prueba de que el efecto adverso del estilo de vida sedentario para la salud corporal y cerebral puede transmitirse a las siguientes generaciones.
Los investigadores han destacado que los hallazgos conseguidos en este trabajo pueden ser valiosos para respaldar políticas sanitarias basadas en la evidencia en contextos como el desarrollo, las enfermedades y el envejecimiento.
12 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
6
 Investigadores españoles han descrito la función clave que desempeña una proteína en el proceso de meiosis, la división celular que origina óvulos o espermatozoides en los mamíferos y que es clave para asegurar la diversidad genética y su estabilidad entre generaciones.
Investigadores españoles han descrito la función clave que desempeña una proteína en el proceso de meiosis, la división celular que origina óvulos o espermatozoides en los mamíferos y que es clave para asegurar la diversidad genética y su estabilidad entre generaciones.
Un equipo científico del Centro de Investigación del Cáncer -centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad de Salamanca (USAL)- ha descrito una nueva función de una enzima en ese proceso y han publicado los resultados de su trabajo en la revista Proceedings of the National Academy of Sciences (PNAS).
Los hallazgos que han logrado los científicos abren nuevas vías para la investigación sobre los mecanismos moleculares de la meiosis y sus posibles implicaciones en la fertilidad y en las enfermedades genéticas, ha informado el Consejo Superior de Investigaciones Científicas.
Las células humanas y animales son “diploides”, es decir que proceden de la fusión de dos gametos que tienen 23 pares de cromosomas cada una (espermatozoide y óvulo).
«La producción de los gametos o células sexuales es uno de los procesos más complejos que ocurren durante el desarrollo y requiere de una forma de división celular altamente especializada denominada meiosis», ha explicado Alberto Martín Pendás, investigador del CIC y uno de los autores del estudio.
Durante esta división se reduce el número de cromosomas a la mitad (23 cromosomas) creando espermatozoides y óvulos a partir de células progenitoras diploides (46 cromosomas).
«Para repartir exactamente a la mitad el contenido cromosómico a cada gameto, las células utilizan un mecanismo muy fiable, en el que cada cromosoma encuentra y se une a su pareja, asegurando de esta forma su ulterior reparto equitativo», añade el científico.
La investigadora Elena Llano, profesora del departamento de Fisiología de la Universidad de Salamanca y autora también del estudio, ha subrayado que el control exhaustivo de los mecanismos implicados en este delicado proceso es fundamental.
Si se producen errores se pueden producir abortos espontáneos e infertilidad o pueden causar enfermedades genéticas, como el síndrome de Down, en el que uno de los gametos aporta 2 copias del cromosoma del par 21, en vez de solo uno, dando lugar a un individuo con 47 cromosomas, ha explicado la investigadora.
«Este trabajo de investigación no solo mejora nuestra comprensión de la meiosis, sino que también subraya la complejidad de los procesos que aseguran la segregación precisa de los cromosomas y la generación de gametos viables», ha añadido Yazmine Bejarano Condezo, coautora del estudio.
Por todo ello, han asegurado los científicos, estas nuevas aportaciones pueden allanar el camino para establecer nuevas estrategias que permitan abordar los desafíos reproductivos y las enfermedades genéticas.
04 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
3
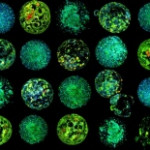 Una nueva tecnología no invasiva es capaz de visualizar el metabolismo de embriones obtenidos por fecundación ‘in vitro’ para decidir cuál tiene más posibilidades de implantarse correctamente en el útero y llegar a término.
Una nueva tecnología no invasiva es capaz de visualizar el metabolismo de embriones obtenidos por fecundación ‘in vitro’ para decidir cuál tiene más posibilidades de implantarse correctamente en el útero y llegar a término.
Se trata de una técnica -probada en ratones- más precisa y fiable que los métodos tradicionales y detrás de ella está el equipo de Bioingeniería en Salud Reproductiva del Instituto de Bioingeniería de Cataluña (IBEC).
El método, bautizado como Metaphor y cuya descripción se publica en la revista PNAS, genera imágenes 3D revelando los colores presentes en el embrión de forma totalmente no invasiva, y usa además inteligencia artificial.
Ciertos compuestos naturalmente fluorescentes del metabolismo de los embriones son clave en procesos como la respiración celular o el consumo de nutrientes, con lo cual Metaphor permite observar de manera fiable el estado de salud del embrión, señala un comunicado del IBEC.
«Esta nueva tecnología ayudará a aumentar la probabilidad de éxito en procesos de reproducción asistida, reduciendo el llamado ‘tiempo hasta el embarazo’, y el desgaste económico y psicológico de las pacientes», destaca Samuel Ojosnegros.
El trabajo describe cómo, en estudios con ratones, se logró duplicar la tasa de acierto al seleccionar embriones viables en comparación con embriólogos que usan microscopía tradicional.
Además del análisis de embriones, el método tiene una gran precisión para analizar el metabolismo de ovocitos, permitiendo seleccionar los más aptos para ser fecundados ‘in vitro’.
El sistema Metaphor discriminó entre ovocitos jóvenes o no con un 96 % de precisión y pudo predecir cuales se desarrollarían en embriones viables con más de un 80 % de precisión, «unos números sin precedentes en el campo».
«Somos capaces de evaluar la pérdida de calidad de los ovocitos asociada a la pérdida de fertilidad con la edad. Buscamos lo que se conoce como ‘firmas moleculares’, características de las células asociadas a esta pérdida de fertilidad, como por ejemplo la distribución de mitocondrias», detalla Anna Seriola, también autora del estudio.
La base tecnológica de Metaphor emplea métodos de inteligencia artificial (IA) para analizar las imágenes metabólicas que se obtienen mediante microscopía hiperespectral.
Mediante esta microscopía se capturan cientos de imágenes que contienen información compleja de muchos metabolitos mezclados de embriones y ovocitos.
Para analizarlos se ha entrenado una herramienta de IA capaz de analizar y clasificar estas imágenes en cuestión de minutos, detalla por su parte Albert Parra.
Actualmente, los investigadores ya están ajustando esta revolucionaria tecnología para evaluar embriones humanos y han incorporado una ‘spin-off’ (empresa) que en los próximos años la podría llevar a las clínicas de reproducción asistida.
01 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
26
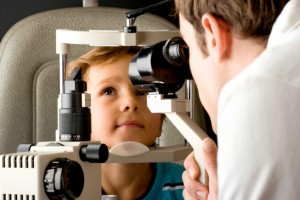 Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Según ha informado este lunes el Centro Superior de Investigaciones Científicas (CSIC), las enfermedades hereditarias de la retina representan la mayor causa de ceguera en el continente europeo, un problema que afecta a 350 000 personas.
Estas enfermedades han sido consideradas incurables durante mucho tiempo ya que se pensaba que la pérdida de visión debido a estas condiciones era irreversible.
Sin embargo, recientemente ha habido un gran interés en el avance de tratamientos novedosos en esta área, por lo que varios grupos de investigación interesados en estas enfermedades se han reunido en una red europea para saber más sobre este tipo de afecciones.
La correcta visión depende de la interacción entre los dos componentes que forman la retina: la retina neural y el epitelio pigmentado.
Aunque las cegueras progresivas convergen finalmente en la degeneración de los denominados ‘fotorreceptores’, frecuentemente están asociadas a la activación de genes exclusivamente en uno de los dos componentes.
En la última década, se ha evidenciado que la actividad de los genes está regulada por la estructura tridimensional del genoma.
En el trabajo, se ha comparado esa estructura tridimensional de los genomas de la retina neural y el epitelio pigmentado, lo que ha permitido la identificación de diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina.
Hasta hace poco el estudio genético de este tipo de enfermedades se centraba en alteraciones en las regiones denominadas «codificantes», es decir las zonas del genoma que albergan los genes que dan lugar a las proteínas.
El problema es que muchos de los pacientes no presentan variaciones en estas regiones, lo que sugiere fallos estructurales en el genoma como potencial causa de estas enfermedades.
Los datos analizados en este proyecto ayudan a definir los paisajes regulatorios de los genes expresados en los compartimentos de la retina neural y el epitelio pigmentado en humanos.
Estas conclusiones ofrecen una referencia «muy importante» para predecir posibles variantes estructurales hereditarias que ayuden en ciertos casos a entender las bases moleculares de su ceguera y mejoren el consejo genético en familiares que aún no han desarrollado la enfermedad.
24 junio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia

