sep
2
 Un reciente estudio apunta que el grosor de la retina puede revelar la susceptibilidad de sufrir este trastorno mental. Este hallazgo puede ser muy útil en materia de prevención y a la hora de diseñar tratamientos personalizados, pero cuando se trata de salud mental no se puede perder de vista el enfoque bio-psico-social.
Un reciente estudio apunta que el grosor de la retina puede revelar la susceptibilidad de sufrir este trastorno mental. Este hallazgo puede ser muy útil en materia de prevención y a la hora de diseñar tratamientos personalizados, pero cuando se trata de salud mental no se puede perder de vista el enfoque bio-psico-social.
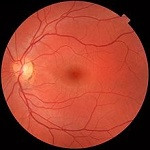
El grosor de la retina puede revelar la susceptibilidad de sufrir esquizofrenia, un trastorno mental grave e incapacitante que en España padecen alrededor de medio millón de personas.
Así lo señala un reciente estudio publicado en Nature Mental Health en el que la Universidad de Zúrich y el Hospital Universitario de Psiquiatría de Zúrich recopilaron información de cerca de 35.000 individuos de la base de datos del UK Biobank.
Elena López Terrones, doctora en Biomedicina y profesora en la Universidad Europea de Valencia, especializada en neurociencia, psicofarmacología y trastornos mentales graves, profundiza en las conclusiones más destacadas de la investigación.
«Las personas con mayor riesgo genético de desarrollar esquizofrenia presentan un adelgazamiento específico de ciertas capas de la retina. Lo más impactante es que esto sucede incluso antes de manifestar síntomas clínicos», señala. En este sentido, explica que las capas más afectadas fueron la mácula y la capa de células ganglionares internas.
«Los axones de estas células ganglionares se juntan formando el nervio óptico, el cual conecta directamente con el cerebro, de ahí que digamos que la retina es una `ventana al cerebro’. Se comprobó que este adelgazamiento no era debido a enfermedades oculares, sino que correlacionaba de manera directa con el riesgo genético de cada persona a sufrir esquizofrenia (a mayor riesgo, más fina la retina)», apunta la doctora.
Y agrega que esta asociación fue particularmente fuerte cuando se centraron en genes relacionados con vías neuroinflamatorias, «lo que sugiere que la inflamación cerebral crónica podría estar detrás de estos cambios». Además, «las personas con mayor riesgo genético también mostraban mayores niveles de proteína C reactiva (CRP), un marcador de inflamación». Por lo tanto, el adelgazamiento de la retina podría ser un biomarcador temprano y no invasivo del riesgo de desarrollar esquizofrenia.
Los resultados se basan en el análisis de datos de casi 35.000 personas. Sobre esta metodología, la doctora apunta que «utilizaron puntuaciones de riesgo poligénico (PRS) para determinar la predisposición genética de cada una a desarrollar esquizofrenia y midieron el grosor de la retina utilizando la tomografía de coherencia óptica (OCT), una técnica totalmente indolora y bastante rápida».
Lo novedoso de la investigación
En palabras de López Terrones, «aunque ya existían estudios que relacionaban la esquizofrenia con el adelgazamiento de la retina, lo novedoso de esta investigación es que analiza datos de personas sin diagnóstico ni síntomas, dando un paso más allá hacia un enfoque preventivo y de detección precoz».
Como menciona, la variable genética juega un papel clave en el grosor de la retina, y al parecer, mediado por procesos inflamatorios. «El estudio encontró que ciertas combinaciones genéticas relacionadas con la neuroinflamación se asocian a una retina más delgada». La neuroinflamación es, en pocas palabras, una especie de «alarma interna» del cerebro que nos dice que algo no va bien. «Sería similar a la fiebre con la que nuestro cuerpo reacciona cuando tenemos una infección o la hinchazón cuando nos damos un golpe. El cerebro tiene sus propias defensas que van a responder cuando las cosas no van como deberían. Esta respuesta inflamatoria está mediada por células del propio sistema nervioso que al activarse liberarán sustancias para intentar proteger el tejido cerebral».
¿Y qué puede activar esa alarma? «Muchas cosas», apunta, y añade: «Desde infecciones (virales o bacterianas), hasta el estrés crónico, alteraciones inmunológicas o, incluso, predisposición genética». En el caso de enfermedades mentales como la esquizofrenia, «se ha observado que este tipo de inflamación puede estar presente de forma persistente, afectando el funcionamiento normal de las neuronas y otras estructuras del cerebro, incluida la retina. Es como si el cerebro viviera en un estado de alerta constante, lo que, a largo plazo, puede provocar cambios sutiles pero importantes en su estructura y función», prosigue.
Al respecto, la OCT, un escáner ocular usado habitualmente por oftalmólogos, es el método de detectar los cambios en la retina que pueden dar la voz de alarma. «Es muy rápido y en tan solo segundos, genera imágenes de alta resolución del interior del ojo», explica y recalca que es no invasivo e indoloro.
`Cautela y perspectiva’ para abordar estos avances
Con lo cual, este hallazgo puede suponer que, «con una prueba sencilla, rápida, no invasiva y mucho más económica que cualquier técnica de neuroimagen, fuera posible detectar el riesgo de desarrollar esquizofrenia». Pero no solo eso: en personas que ya presentan síntomas, también podría ayudar a prever cómo evolucionará la enfermedad.
«Este avance puede ser clave en el terreno de la prevención. Si una persona muestra un alto riesgo genético, podría beneficiarse de psicoeducación específica, que le ayude a reconocer señales tempranas y acudir antes a un especialista. Sabemos que cuanto antes se inicia el tratamiento, mejor pronóstico hay: uno de los factores de mal pronóstico es haber pasado demasiado tiempo con síntomas sin recibir ayuda», sostiene López Terrones.
Para mayor información, leer el PDF adjunto.
20 agosto 2025 | Fuente: IM Médico | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
sep
25
 Investigadores de la Universidad de Alicante (UA) han descubierto un extracto de alga que podría prevenir y mejorar enfermedades neurodegenerativas de la retina, según ha informado este lunes la institución académica, que ha señalado que la especie se obtiene de ambientes degradados, de manera que su utilización es respetuosa con los hábitats naturales.
Investigadores de la Universidad de Alicante (UA) han descubierto un extracto de alga que podría prevenir y mejorar enfermedades neurodegenerativas de la retina, según ha informado este lunes la institución académica, que ha señalado que la especie se obtiene de ambientes degradados, de manera que su utilización es respetuosa con los hábitats naturales.
Los responsables del hallazgo son científicos del Departamento de Ciencias del Mar y Biología Aplicada de la UA, que han constatado que un extracto del alga Ulva australis, comúnmente conocida como lechuga del mar del sur, presenta actividad antioxidante y actividad proliferativa celular para su empleo como medicamento.
En concreto, algunos metabolitos de esta alga pueden aplicarse tanto para prevenir como para tratar patologías neurodegenerativas de la retina.
El profesor de la UA Federico López Moya ha explicado que «el hallazgo de las algas del género Ulva como nueva fuente de metabolitos ha sido muy sorprendente».
«En este estudio se ha evaluado la actividad antioxidante de los extractos, especialmente sobre células asociadas a enfermedades que cursan estrés oxidativo en la retina”, ha concretado López Moya.
Los investigadores consideran que esta primera aproximación basada en la implementación de métodos dentro de la Biotecnología Marina puede suponer el inicio de un camino que finalice en el desarrollo de soluciones para algunas enfermedades neurodegenerativas.
Por su parte, el también investigador del departamento de Ciencias del Mar y Biología Aplicada de la UA Miguel Valverde Urrea ha revelado que, para seleccionar la especie de alga con capacidad antioxidante han llevado a cabo un screening en el mar, «puesto que existen especies de algas que cuentan con numerosas propiedades y ofrecen recursos no explotados”.
Además, «el valor añadido de Ulva australis es que ofrece extractos estables y de fácil obtención, más sostenibles desde un punto de vista ambiental», ha destacado,
Los expertos han contado con la colaboración del departamento de Óptica, Farmacología y Anatomía de la UA para realizar la simulación de enfermedades de la retina en laboratorio.
Al producir estrés oxidativo en células y añadir los extractos del alga, los resultados han determinado que los metabolitos tienen tanto capacidad proliferativa como de protección oxidativa sobre las células.
Los autores sostienen que «los resultados ponen de manifiesto el potencial para su desarrollo como estrategia para mitigar enfermedades asociadas a la pérdida de fotorreceptores, como la degeneración macular asociada a la edad, el glaucoma y otras retinopatías que afectan a la población».
El descubrimiento de los investigadores de la UA, que se encuentra patentado, tiene como objetivo final sentar las bases biotecnológicas que permitan desarrollar estrategias para prevenir y tratar las afecciones neurodegenerativas de la retina.
Igualmente, según fuentes de la institución académica, el hallazgo del extracto de alga permite trabajar con un recurso natural respetuoso con el medio ambiente, de gran disponibilidad y fácil obtención.
23 septiembre 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
26
 Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Según ha informado este lunes el Centro Superior de Investigaciones Científicas (CSIC), las enfermedades hereditarias de la retina representan la mayor causa de ceguera en el continente europeo, un problema que afecta a 350 000 personas.
Estas enfermedades han sido consideradas incurables durante mucho tiempo ya que se pensaba que la pérdida de visión debido a estas condiciones era irreversible.
Sin embargo, recientemente ha habido un gran interés en el avance de tratamientos novedosos en esta área, por lo que varios grupos de investigación interesados en estas enfermedades se han reunido en una red europea para saber más sobre este tipo de afecciones.
La correcta visión depende de la interacción entre los dos componentes que forman la retina: la retina neural y el epitelio pigmentado.
Aunque las cegueras progresivas convergen finalmente en la degeneración de los denominados ‘fotorreceptores’, frecuentemente están asociadas a la activación de genes exclusivamente en uno de los dos componentes.
En la última década, se ha evidenciado que la actividad de los genes está regulada por la estructura tridimensional del genoma.
En el trabajo, se ha comparado esa estructura tridimensional de los genomas de la retina neural y el epitelio pigmentado, lo que ha permitido la identificación de diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina.
Hasta hace poco el estudio genético de este tipo de enfermedades se centraba en alteraciones en las regiones denominadas «codificantes», es decir las zonas del genoma que albergan los genes que dan lugar a las proteínas.
El problema es que muchos de los pacientes no presentan variaciones en estas regiones, lo que sugiere fallos estructurales en el genoma como potencial causa de estas enfermedades.
Los datos analizados en este proyecto ayudan a definir los paisajes regulatorios de los genes expresados en los compartimentos de la retina neural y el epitelio pigmentado en humanos.
Estas conclusiones ofrecen una referencia «muy importante» para predecir posibles variantes estructurales hereditarias que ayuden en ciertos casos a entender las bases moleculares de su ceguera y mejoren el consejo genético en familiares que aún no han desarrollado la enfermedad.
24 junio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
abr
17
 Investigadores de la Universidad de Rochester, Estados Unidos, descubrieron que el parpadeo desempeña un rol esencial en el procesamiento de la información visual, publica hoy las Actas de la Academia Nacional de Ciencias.
Investigadores de la Universidad de Rochester, Estados Unidos, descubrieron que el parpadeo desempeña un rol esencial en el procesamiento de la información visual, publica hoy las Actas de la Academia Nacional de Ciencias.
Los expertos destacaron que el acto ordinario de parpadear ocupa una sorprendente cantidad del tiempo de vigilia, pues los seres humanos, en promedio, pasan entre un tres y ocho por ciento de su tiempo despierto con los párpados cerrados.
Dado que los parpadeos impiden que se forme una imagen de la escena externa en la retina, es una peculiaridad de la evolución que pasemos tanto tiempo en este estado aparentemente vulnerable, especialmente considerando que los parpadeos ocurren con más frecuencia de lo necesario solo para mantener nuestros ojos bien lubricados.
«Al modular la entrada visual a la retina, los parpadeos reformatean efectivamente la información visual, produciendo señales de luminancia que difieren drásticamente de las que normalmente experimentamos cuando miramos un punto de la escena», explicó Michele Rucci, profesora del Departamento de Cerebro y Ciencias Cognitivas.
Rucci y sus colegas rastrearon los movimientos oculares de observadores humanos y combinaron estos datos con modelos informáticos y análisis espectral (analizando las diversas frecuencias de los estímulos visuales) para estudiar cómo el parpadeo afecta lo que ven los ojos en comparación con cuando los párpados están cerrados.
Los investigadores midieron qué tan sensibles son los humanos a la hora de percibir diferentes tipos de estímulos, como patrones en diferentes niveles de detalle.
Descubrieron que cuando las personas parpadean, notan mejor patrones grandes que cambian gradualmente, es decir, el parpadeo proporciona información al cerebro sobre el panorama general de una escena visual.
Los resultados muestran que cuando parpadeamos, el movimiento rápido del párpado altera los patrones de luz que son eficaces para estimular la retina.
Esto crea un tipo diferente de señal visual para nuestro cerebro en comparación con cuando nuestros ojos están abiertos y enfocados en un punto específico, recalcaron los expertos.
15 abril 2024|Fuente: Prensa Latina |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
mar
1
 La entrega intravitreal de una isoforma de la fractalquina mejora tanto la histología como la agudeza visual, en un modelo animal. Científicos de diversos centros estadounidenses han desarrollado una terapia génica que, aplicada de manera profiláctica, previene el a la retina asociado a la diabetes.
La entrega intravitreal de una isoforma de la fractalquina mejora tanto la histología como la agudeza visual, en un modelo animal. Científicos de diversos centros estadounidenses han desarrollado una terapia génica que, aplicada de manera profiláctica, previene el a la retina asociado a la diabetes.
La terapia se basa en la vehiculización de la quimioquina conocida como fractalquina en un vector viral, y puede ser entregada intravitrealmente, ofreciendo protección tanto a nivel neurológico como vascular. Astrid Cardona, investigadora de la Universidad de Texas y directora del estudio, afirma que los animales tratados exhibieron una menor pérdida de células neuronales en la retina y menos daño axonal y astrogliosis en el nervio óptico, con una consistente reducción de la microgliosis. Los vasos retinales mostraron, además, una reducida deposición de fibrinógeno y una disminución de la neovascularización. Notablemente, la agudeza visual a las 4 y 10 semanas fue superior a la de los ratones control.
Cardona señala, no obstante, que el grupo control estuvo constituido por ratones genéticamente deficientes en fractalquina. La científica prosigue indicando que la actividad terapéutica estuvo circunscrita a la isoforma soluble de la fractalquina, siendo la isoforma de membrana inactiva en este modelo.
Estos hallazgos son consistentes con los de estudios previos, en los que la deficiencia genética del receptor de la fractalquina se asoció a los mismos rasgos histopatológicos retinales observados en el actual trabajo. Los investigadores valoran positivamente los resultados, señalando que esta forma soluble modula múltiples factores relevantes en el desarrollo de la retinopatía diabética, con las consiguientes implicaciones en el desarrollo de futuras terapias.
Ver artículo: Rodriguez D, Church KA, Pietramale AN, Cardona SM, Vanegas D, Rorex C, et al. Fractalkine isoforms differentially regulate microglia-mediated inflammation and enhance visual function in the diabetic retina. J Neuroinflammation[Internet]. 2024[citado 29 feb 2024];21(1):42. doi: 10.1186/s12974-023-02983-8.
29 febrero 2024| Fuente: IMMédico| Noticia| Oftalmología
feb
6
 Una investigación del grupo RETOS, de la Facultad de Medicina y Ciencias de Salud la Universidad Católica de Valencia (UCV), supone el inicio de una posible alternativa terapéutica basada en microARN que conduzca ‘a la curación de la pérdida de visión y la ceguera’ causada por la diabetes y la degeneración macular asociada a la edad.
Una investigación del grupo RETOS, de la Facultad de Medicina y Ciencias de Salud la Universidad Católica de Valencia (UCV), supone el inicio de una posible alternativa terapéutica basada en microARN que conduzca ‘a la curación de la pérdida de visión y la ceguera’ causada por la diabetes y la degeneración macular asociada a la edad.
La revista científica International Journal of Molecular Sciences publica en los últimos hallazgos del equipo de investigadores de la UCV, dirigido por Jorge Barcia y Javier Sancho, en un artículo denominado ‘Role of exosomal miR-205-5p-cargo in angiogenesis and cell migration’, según explican desde la UCV.
El estudio realizado por RETOS recoge parte de los resultados obtenidos por Miriam Martínez y María Ybarra en sus tesis doctorales, y la clave de la investigación se halla en el papel represor del exosomal miR-205-5p sobre la creación de nuevos vasos sanguíneos (angiogénesis). Aunque todavía está lejos de su aplicación inmediata, el grupo está trabajando actualmente con un modelo animal de diabetes para validar el papel del microARN sobre la angiogénesis.
La creación excesiva de estos vasos en la retina es la que ocasiona la pérdida de visión en pacientes diabéticos o en la degeneración macular relacionada con el envejecimiento’, indican los investigadores.
En este caso, la investigación describe cómo el exosomal miR-205-5p viaja en pequeñas vesículas extracelulares (exosomas) y es capaz de inhibir la angiogénesis inducida por niveles altos de glucosa.
RETOS ha podido llevar a cabo el presente estudio gracias a la financiación del Ministerio de Ciencia e Innovación y del Instituto de Salud Carlos III, y desde el año pasado, han obtenido también una subvención para el desarrollo científico por parte de la Comisión Europea dentro del programa Horizonte Europa, como coordinadores y socios del proyecto RETORNA Doctoral Networks.
El objetivo de RETORNA es encontrar nuevas terapias basadas en ARN contra enfermedades de la visión y, a tal efecto, esta red investigadora proporciona una plataforma internacional innovadora y multidisciplinaria para formar a jóvenes científicos en el campo de las ciencias de la visión.
Ver artículo completo: Martínez Santos M, Ybarra M, Oltra M, Muriach M, Romero FJ, Pires ME, et al. Role of Exosomal miR-205-5p Cargo in Angiogenesis and Cell Migration.Int J Mol Sci [Internet]. 2024[citado 5 feb 2024];25(2):934. doi: 10.3390/ijms25020934.
5 febrero 2024| Fuente: EFE| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A

