abr
3
 La nueva vacuna, la vacuna PfSPZ-LARC2, para prevenir la infección por malaria desarrollada por el Instituto de Investigación Infantil de Seattle y Sanaria, está lista para ser probada en humanos
La nueva vacuna, la vacuna PfSPZ-LARC2, para prevenir la infección por malaria desarrollada por el Instituto de Investigación Infantil de Seattle y Sanaria, está lista para ser probada en humanos
En un informe publicado el 21 de marzo de 2024 en EMBO Molecular Medicine (A replication competent Plasmodium falciparum parasite completely attenuated by dual gene deletion), investigadores del Seattle Children’s Research Institute y Sanaria describen el desarrollo de una cepa completa de vacuna contra el parásito de la malaria que infecta el hígado, se desarrolla hasta la etapa hepática tardía, y luego se atasca por completo y no puede salir del hígado para causar una infección sintomática de la sangre.
La creación de esta cepa llamada LARC2 (Late hepática Arresting, Replication Competent) se logró mediante la deleción de solo dos genes del parásito de los aproximadamente 5.000 en el genoma del parásito Plasmodium falciparum (Pf), Esta cepa del parásito incapacitada será el único inmunógeno en la vacuna de tercera generación de Sanaria, la vacuna Sanaria PfSPZ LARC2.
El estudio fue dirigido por el Dr. Debashree Goswami y el Dr. Hardik Patel, que trabajan en el laboratorio del Dr. Stefan Kappe en el Instituto de Investigación Infantil de Seattle y un equipo de Sanaria dirigido por el Dr. B. Kim Lee Sim.
Los mosquitos inoculan parásitos de la malaria llamados esporozoítos (SPZ, por sus siglas en inglés), que infectan rápidamente las células hepáticas dentro de las cuales cada parásito individual puede multiplicarse para producir hasta 50.000 parásitos en 6-7 días.
Esta primera fase de la infección pasa completamente desapercibida y no causa ningún síntoma. Cuando los parásitos salen del hígado, infectan decenas de miles de glóbulos rojos, causando la enfermedad mortal de la malaria.
El equipo de Kappe, en colaboración con la doctora Ashley Vaughan del Instituto de Investigación Infantil de Seattle, construyó la cepa LARC2 mediante la eliminación de dos genes críticos sin los cuales los parásitos se multiplican en el hígado casi hasta la madurez, pero luego se desintegran, lo que evita que nuevos parásitos entren en el torrente sanguíneo.
De esta manera, los parásitos LARC2 estimulan una respuesta inmunitaria muy fuerte en el hígado, que protege contra futuras infecciones de malaria. Al evaluar la PfSPZ-LARC2 aséptica, purificada y criopreservada producida en Sanaria en ratones humanizados con células hepáticas humanas y glóbulos rojos humanos, el equipo del estudio pudo demostrar que las etapas hepáticas maduras y tardías del ciclo de vida del parásito de la malaria estaban completamente comprometidas.
Estas cepas de parásitos debilitadas pueden registrarse, pero no pueden salir», dice Kappe, quien también es profesor en el Departamento de Pediatría de la Universidad de Washington.
El fundador y director ejecutivo de Sanaria, Stephen L. Hoffman, MD, dijo: «La vacuna PfSPZ-LARC2 de Sanaria tiene el potencial de salvar millones de vidas y eliminar la malaria de áreas geográficas definidas cuando se administra en programas de vacunación masiva. Tenemos previsto evaluar la vacuna PfSPZ-LARC2 en ensayos clínicos en 2024 en Estados Unidos, Alemania y Burkina Faso.
Las generaciones anteriores de vacunas PfSPZ no cumplen los requisitos de la OMS de una protección del 90% contra la infección o tienen el potencial de provocar infecciones irruptivas en el torrente sanguíneo.
Para proteger contra el paludismo y eliminarlo, la OMS ha reconocido la necesidad de vacunas que prevengan la infección en estadio sanguíneo humano en personas que tengan una eficacia vacunal del >90% durante al menos 12 meses contra la infección por paludismo por Plasmodium falciparum transmitido de forma natural, que es responsable del >98% de las 625.000 muertes por paludismo.
Solo las vacunas contra el esporozoíto de P. falciparum de Sanaria han logrado una eficacia vacunal del >90% contra las infecciones controladas de malaria humana y han mostrado una protección sostenida sin refuerzos contra la transmisión natural en África. Se predice que los parásitos PfSPZ-LARC2 inducen fuertes respuestas inmunitarias celulares en el hígado que serán altamente protectoras contra la infección. En su publicación, el equipo del estudio demostró que la vacunación con LARC2 protege completamente contra la infección en modelos de ratón de malaria.
Nos tomó casi 20 años llegar a la vacuna PfSPZ-LARC2″, dice Kappe. Encontrar los genes correctos que, cuando se eliminan del genoma del parásito, detienen al parásito justo cuando quiere salir del hígado, fue una tarea enorme. Nuestros resultados proporcionan una clara indicación de que es posible una atenuación segura y completa del desarrollo de los parásitos de la malaria y estamos entusiasmados de ver el resultado de los primeros ensayos clínicos con esta vacuna».
Estamos entusiasmados con el potencial de la vacuna PfSPZ-LARC2 para prevenir la malaria en los viajeros a regiones endémicas, y en mujeres embarazadas y niños en áreas con malaria y, finalmente, para eliminar la malaria de regiones enteras», dijo el profesor Peter Kremsner, director del Instituto de Medicina Tropical de la Universidad de Tübingen en Alemania, y presidente del Centre de Recherches Médicales de Lambaréné (CERMEL) en Gabón.
02 abril 2024| Fuente: EurekAlert| Tomado de | Comunicados prensa
mar
30
 La farmacéutica Moderna anunció que inició la última fase de pruebas clínicas para el desarrollo de cuatro nuevas vacunas contra infecciones latentes, entre ellas la varicela y el herpes, así como la norovirus responsable de brotes de gastroenteritis.
La farmacéutica Moderna anunció que inició la última fase de pruebas clínicas para el desarrollo de cuatro nuevas vacunas contra infecciones latentes, entre ellas la varicela y el herpes, así como la norovirus responsable de brotes de gastroenteritis.
Las cuatro vacunas contra infecciones latentes son para enfermedades provocadas por virus de la familia herpesvirus: citomegalovirus (la infección que causa más defectos congénitos en Estados Unidos), el virus de Epstein-Barr (principal causa de mononucleosis aguda infecciosa), el virus del herpes simple y el virus varicela-zóster (responsable de la varicela).
Además, la farmacéutica está en la última fase de desarrollo de una vacuna contra el norovirus que causa brotes de gastroenteritis en todo el mundo y unas 200.000 muertes al año.
Moderna también aprovechó la celebración este miércoles de su quinto Día de las Vacunas para anunciar una vacuna de nueva generación contra la covid-19 efectiva tanto para las variantes omicron BA.4 y BA.5 como para las cepas originales del SARS-CoV-2.
Esta nueva generación de vacuna contra la covid-19 ha permitido a la compañía el desarrollo de un candidato a vacuna contra la gripe y la covid-19 para personas mayores de 50 años. La compañía valoró en 10.000 millones de dólares anuales el mercado mundial de covid-19 endémico.
Covid-19 sigue siendo una enfermedad de elevada carga y aunque las hospitalizaciones por covid-19 siguen siendo elevadas con relación al virus respiratorio sincitial humano (VRS) y la gripe, los riesgos del covid de larga duración están empezando a ser entendidos mejor’, señaló la compañía en un comunicado.
Con respecto a VRS, que afecta principalmente a niños y puede producir secuelas a largo plazo, Moderna señaló que su candidato a vacuna está en fase 2/3 de pruebas clínicas en la que participan 37.000 personas de más de 60 años en 22 países.
Moderna espera que la vacuna sea aprobada por las autoridades estadounidenses en 2024. En estos momentos, la única vacuna comercial de Moderna es la de la covid-19 que utiliza la técnica de ARN mensajero que es también la base de todas las vacunas que la compañía está desarrollando.
Nueva York, 27 marzo 2024|Fuente: EFE| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
mar
30
 Una terapia con anticuerpos, descrita en la revista Nature, ha logrado rejuvenecer el sistema inmune en ratones de avanza edad y los investigadores creen que será viable en humanos una vez supere estudios preclínicos y clínicos.
Una terapia con anticuerpos, descrita en la revista Nature, ha logrado rejuvenecer el sistema inmune en ratones de avanza edad y los investigadores creen que será viable en humanos una vez supere estudios preclínicos y clínicos.
A medida que las personas envejecen el sistema inmune se debilita y hay dificultades para combatir enfermedades y nuevos virus, y que las vacunas para combatir estos últimos tengan efecto, como ocurrió con el covid-19.
Causa del deterioro La causa está en las células hematopoyéticas o células madre adultas, encargadas de producir linfocitos, que defienden el cuerpo ante cualquier nueva amenaza (inmunidad adaptativa), y células mieloides, que responden con inflación ante los patógenos (inmunidad innata).
El investigador de la Facultad de Medicina de la Universidad de Stanford, Irving Weissman, uno de los autores del presente estudio, aisló estas células madre adultas en ratones y humanos a finales de los años ochenta.
Sus investigaciones han mostrado cómo en la última etapa de la vida, la producción de linfocitos y células mieloides por parte de las células madre adultas se desequilibra: cae la creación de linfocitos, y con ella la capacidad de reacción ante nuevos virus y bacterias, y sube la de células mieloides, que acaban con cualquier célula desconocida mediante respuestas inflamatorias.
Esta inflamación supone un problema en el momento en que se desencadena de forma inadecuada o en exceso, como ocurre con el envejecimiento, cuando las personas experimentan una especie de inflación crónica por la abundancia de producción de células mieloides en detrimento de los linfocitos.
Al principio de la historia de la humanidad, cuando la gente no se movía del lugar donde había nacido y convivía con los mismos patógenos toda su vida, producir menos linfocitos en la vejez no era un gran problema.
Sin embargo, ahora que la movilidad favorece la continua aparición de virus y bacterias desconocidos, sí que lo es. ¿Rejuvenecer el sistema inmune? La pregunta que se hicieron los investigadores era si es posible mantener un sistema inmune más joven, disminuyendo las células madre adultas de tendencia mieloide y aumentando las más equilibradas, que también producen linfocitos. Los experimentos con ratones han confirmado que sí.
Trataron a roedores de entre 18 y 24 meses de edad (equivalentes a más de 70 años en humanos) con un anticuerpo dirigido a destruir células madre adultas de tendencia mieloide y a sustituirlas por otras más equilibradas, con más presencia de linfocitos.
El tratamiento también redujo algunas consecuencias negativas, como la inflamación que puede surgir cuando un sistema inmunitario envejecido se enfrenta a un nuevo patógeno.
Cuando dos meses después se vacunó a los ratones geriátricos tratados contra un virus al que no se habían enfrentado antes, vieron cómo sus sistemas inmunitarios respondieron mucho mejor que los de los animales sin tratar.
Cuatro meses después de la administración de la terapia, los ratones con un sistema inmunitario rejuvenecido, desarrollaron una mejor respuesta inmunitaria frente a un virus contra el que habían sido previamente vacunados.
Similares a los humanos Los investigadores también han demostrado que las células madre adultas de ratón y las humanas son lo bastante similares como para que algún día sea posible utilizar una técnica similar al sistema inmunitario humano envejecido, logrando que las personas sean menos vulnerables a nuevas infecciones y presenten una mejor respuesta a la vacunación en edades avanzadas.
Creemos que este estudio da los primeros pasos para aplicar esta estrategia en humanos. Si podemos revitalizar el sistema inmunitario humano envejecido como hicimos en ratones, podría salvar vidas cuando venga la próxima pandemia’, afirma otra de las autoras, Ross Myers, del Laboratorio Rocky Mountain del Instituto Nacional de la Salud de EE.UU. Óscar de la Calle-Martín, secretario de la Sociedad Española de Inmunología, recuerda que el incremento en el número de células mieloides en pacientes de edad avanzada reduce la supervivencia en un gran número de enfermedades asociadas a la edad.
Equilibrar la producción de estas células puede ayudar al tratamiento de enfermedades tan prevalentes como la ateroesclerosis, las enfermedades neurodegenerativas, la osteoporosis o el cáncer’, subraya en una reacción recogida por la plataforma Science Media Center.
Los investigadores médicos, Yasar Arfat Kasu y Robert Signer, de la Universidad de California San Diego, advierten, no obstante, de que el aumento de la producción de linfocitos en los adultos mayores podría aumentar el riesgo de crecimiento tumoral (como la leucemia), que se ha demostrado que se suprime con la reducción de la producción linfoide.
Sin embargo, la carga de un mayor riesgo de leucemia linfoide podría verse compensada por la mayor protección frente a infecciones y el menor riesgo de otros cánceres si existiera una vigilancia inmunológica mayor con terapias como esta.
Ver artículo: Ross JB, Myers LM, Noh JJ, Collins MM, Carmody AB, Messer RJ, et al. Depleting myeloid-biased haematopoietic stem cells rejuvenates aged immunity. Nature[Internet].2024[citado 29 mar 2024]. DOIhttps://doi.org/10.1038/s41586-024-07238-x
Redacción Ciencia, 27 marzo 2024|Fuente: EFE| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A
mar
12
 Las mujeres constituyen el 70% de los trabajadores en el sector sanitario y asistencial a nivel mundial, apenas el 25% ocupa posiciones de liderazgo. En un evento con motivo del Día Internacional de la Mujer, el Director de la Organización Panamericana de la Salud (OPS), Jarbas Barbosa, llamó a respaldar el liderazgo femenino mientras se fortalece la fuerza laboral sanitaria tras los impactos negativos de la pandemia de COVID-19.
Las mujeres constituyen el 70% de los trabajadores en el sector sanitario y asistencial a nivel mundial, apenas el 25% ocupa posiciones de liderazgo. En un evento con motivo del Día Internacional de la Mujer, el Director de la Organización Panamericana de la Salud (OPS), Jarbas Barbosa, llamó a respaldar el liderazgo femenino mientras se fortalece la fuerza laboral sanitaria tras los impactos negativos de la pandemia de COVID-19.
No podemos lograr la salud universal ni alcanzar los Objetivos de Desarrollo Sostenible (ODS) sin equidad en salud e igualdad de género en el sector de la salud», afirmó el doctor Barbosa durante el diálogo de alto nivel «El liderazgo de las mujeres en la agenda regional de salud y resiliencia», organizado por el Task Force Interamericano Sobre el Liderazgo de las Mujeres, con el apoyo del Gobierno de Canadá y bajo la coordinación de la Comisión Interamericana de Mujeres de la Organización de los Estados Americanos (CIM/OEA).
Director de la OPS resaltó las desafiantes barreras que enfrentan las trabajadoras de la salud, lo cual repercute en su bienestar económico, social y el de sus comunidades. El doctor Barbosa pidió garantizar la representación femenina en los espacios de toma de decisiones, enfatizando la importancia de escuchar sus voces. «Debemos construir sociedades más equitativas, con igualdad de género, resilientes y sostenibles», lo que implica «invertir en las mujeres y su liderazgo», destacó.
Un análisis de género y equidad del personal sanitario y social mundial realizado por la OMS revela que las diferencias de liderazgo entre hombres y mujeres son resultado de estereotipos, discriminación, desequilibrio de poder y privilegios. Además, sus desventajas se multiplican cuando se entrelazan con factores como la raza y la clase social. Las mujeres ocupan puestos de menor categoría y reciben salarios más bajos en comparación con los hombres en el sector sanitario. Esta brecha salarial de género, que alcanza el 26%, es más alta que en otros sectores.
La OPS es una de las diez organizaciones de las Naciones Unidas donde las mujeres constituyen más del 50% de su fuerza laboral. Además, la equidad y la igualdad de género son valores fundamentales de la Organización, integrados en todas las políticas, programas y en la cooperación técnica.
En la OPS, estamos comprometidos a invertir en las mujeres y creemos firmemente que incorporar las voces y perspectivas de las mujeres y las niñas en la toma de decisiones es esencial para construir sistemas de salud resilientes, algo que impactará positivamente en la salud y el desarrollo,” remarcó.
El Secretario General de la OEA, Luis Almagro, resaltó el compromiso histórico de la Organización con la igualdad de género, manifestado en sus convenciones y la Carta Democrática Interamericana. Destacó el papel pionero de la OEA en la promoción de la igualdad de género en las Américas durante casi 100 años, a través de la Comisión Interamericana de la Mujer, y mencionó el marco normativo construido por la OEA en materia de derechos de las mujeres, que ha contribuido a la vanguardia regional en temas como la paridad en procesos electorales y la mayor representación femenina en las esferas de poder.
Sin embargo, reconoció que persisten desigualdades de género en diversos ámbitos, incluido el derecho a la salud, especialmente evidenciadas durante la pandemia. Almagro destacó la necesidad de «adoptar enfoques transformadores» para modificar “las estructuras y normas sociales que perpetúan la discriminación de género.
La doctora Rhonda Sealey-Thomas, Subdirectora de la OPS, participó en el panel sobre la participación y liderazgo de las mujeres en la agenda sanitaria regional: Oportunidades y retos. Destacó el compromiso de la Organización para aumentar la representación de las mujeres en puestos de liderazgo dentro de la OPS y para garantizar que las mujeres de la región puedan llevar una vida productiva y alcanzar su pleno potencial.
En ese sentido, destacó la Política sobre el personal de salud 2030, que busca incorporar una perspectiva de género en las políticas laborales del sector de la salud. En cuanto al acceso de las mujeres a los servicios de salud, la doctora Sealey-Thomas mencionó el programa de eliminación del cáncer cervicouterino de la OPS, y enfatizó la importancia de mejorar el acceso a las pruebas y vacunas contra el VPH. «A través de la OPS, los países pueden mejorar el acceso a herramientas esenciales que pueden salvar la vida de las mujeres y darles la oportunidad de vivir vidas productivas para que puedan asumir posiciones de liderazgo.
08 marzo 2024|Fuente: OPS |Tomado de | Noticias
mar
7
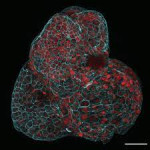 Los científicos han creado miniórganos a partir de células que flotan en el líquido que rodea al feto en el útero, un avance que creen que podría abrir nuevas áreas de la medicina prenatal. Los miniórganos u ‘organoides’ son diminutas estructuras simplificadas que pueden utilizarse para probar nuevos tratamientos médicos o para estudiar el funcionamiento de los órganos reales a los que imitan, sea que estén sanos o enfermos.
Los científicos han creado miniórganos a partir de células que flotan en el líquido que rodea al feto en el útero, un avance que creen que podría abrir nuevas áreas de la medicina prenatal. Los miniórganos u ‘organoides’ son diminutas estructuras simplificadas que pueden utilizarse para probar nuevos tratamientos médicos o para estudiar el funcionamiento de los órganos reales a los que imitan, sea que estén sanos o enfermos.
Investigadores del University College de Londres y del Hospital Great Ormond Street del Reino Unido recogieron células de muestras de líquido amniótico que fueron tomadas durante 12 embarazos como parte de las pruebas prenatales rutinarias. Después, por primera vez, cultivaron miniórganos a partir de células tomadas durante embarazos activos.
Con el tiempo, su método podría ayudar a los médicos a controlar y tratar enfermedades congénitas antes del nacimiento y a desarrollar terapias personalizadas para el bebé en el útero. ‘Estamos muy ilusionados’ con esta posibilidad, afirmó Mattia Gerli, del University College de Londres y autor del estudio publicado el lunes en la revista Nature Medicine. Las células madre de tejidos específicos que recogieron Gerli y sus colegas fueron desprendidas por el feto, como ocurre normalmente durante el embarazo.
Los científicos identificaron de qué tejidos procedían las células madre y hallaron células de los pulmones, los riñones y los intestinos. Hasta ahora, los miniórganos se obtenían de células madre de adultos que se asemejaban más al tejido adulto o de tejido fetal tras un aborto. La extracción de células del líquido amniótico elude la normativa que prohíbe extraer células madre directamente del tejido fetal, lo que permite a estos científicos obtener células de fetos en la última parte del embarazo.
En el Reino Unido, el límite legal para interrumpir un embarazo suele ser 22 semanas después de la concepción. Los científicos no pueden obtener muestras fetales después de esa fecha, lo que limita su capacidad para estudiar el desarrollo humano normal o las enfermedades congénitas más allá de ese momento. En Estados Unidos, las restricciones al aborto varían según el estado. En la mayoría es legal utilizar tejido fetal para la investigación, explicó Alta Charo, catedrática emérita de Derecho y Bioética de la Universidad de Wisconsin en Madison.
Los Institutos Nacionales de la Salud de Estados Unidos definen el tejido fetal como aquel procedente de un embrión o feto humano muerto tras un aborto espontáneo, un aborto o una muerte fetal, y el uso de tejido procedente de un aborto ha sido motivo de controversia durante mucho tiempo. Charo, que no participó en el estudio, afirma que el nuevo método no plantea los mismos problemas éticos. ‘La obtención de células a partir de líquido amniótico del que ya se toman muestras con fines clínicos estándar no parece añadir ningún riesgo físico ni para el feto ni para la mujer embarazada’, indicó en un correo electrónico. El doctor Arnold Kriegstein, que dirige el Programa de Biología del Desarrollo y de Células Madre de la Universidad de California, campus San Francisco, y quien tampoco participó en la investigación, dijo que obtener células de esta manera tiene ‘el potencial de brindar cierta información acerca del feto individual mientras está creciendo’. Y ya que cultivar miniórganos a partir de las células contenidas en el liquido amniótico tarda entre 4 y 6 semanas, la terapia prenatal cuenta con suficiente tiempo para solucionar los problemas que los médicos puedan detectar, indicó Gerli. Para examinar una aplicación práctica de su método, el equipo británico trabajó con colegas en Bélgica para estudiar el desarrollo de bebés con una afección llamada hernia diafragmática congénita, en la cual órganos como el hígado y los intestinos se desplazan hacia el tórax debido a un agujero en el diafragma.
Los pulmones no se desarrollan como deberían, y alrededor del 30% de los fetos con esta afección mueren. Si los médicos detectan la hernia, pueden operar al feto cuando todavía se encuentra en el útero. Los investigadores cultivaron organoides pulmonares a partir de células de fetos con esa afección antes y después del tratamiento y los compararon con organoides de fetos sanos.
El doctor Paolo de Coppi, uno de los autores del estudio del University College de Londres y del Hospital Great Ormond Street, dijo que pudieron evaluar el estado del niño afectado antes del nacimiento gracias a este método. Por el momento, los médicos no son capaces de decirle mucho a las familias sobre los resultados de un diagnóstico prenatal porque cada caso es diferente, explicó. La capacidad de estudiar el funcionamiento de miniórganos prenatales, agregó De Coppi, es el primer paso hacia un pronóstico más detallado y tratamientos más eficaces. Kriegstein señaló que es necesario seguir investigando. ‘Estamos en una fase muy temprana’, añadió, ‘y tendremos que esperar para ver su utilidad a largo plazo’. El Departamento de Salud y Ciencia de The Associated Press recibe apoyo del Grupo de Medios Educativos y de Ciencia del Instituto Médico Howard Hughes. La AP es la única responsable de todo el contenido.
05 marzo 2024 | Fuente: AFP| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A
mar
4
 Las recomendaciones tienen como objetivo no sólo brindar a los médicos interesados respuestas a las preguntas más importantes relacionadas con el manejo de pacientes, sino también ayudar a estandarizar la presentación de informes de ensayos clínicos.
Las recomendaciones tienen como objetivo no sólo brindar a los médicos interesados respuestas a las preguntas más importantes relacionadas con el manejo de pacientes, sino también ayudar a estandarizar la presentación de informes de ensayos clínicos.
El tratamiento de la leucemia linfoblástica aguda (LLA) en adultos es extremadamente complejo, prolongado y muy estresante para los pacientes. En comparación con otros tipos de cáncer en adultos, la LLA es relativamente rara, por lo que su tratamiento en Europa ha sido organizado durante décadas por grupos de estudio multicéntricos.
Después de tres años de intensa colaboración, los principales expertos europeos en LLA en adultos han elaborado recomendaciones consensuadas, agrupando por primera vez la experiencia europea en una sola directriz, bajo la dirección del Dr. Nicola Gökbuget, médico jefe de la Clínica Médica 2 del Hospital Universitario de Frankfurt, y difundidos por la Red Europea contra la Leucemia (ELN, por sus siglas en inglés) en un informe especial. «El conocimiento sobre la biología de la enfermedad y las opciones de tratamiento para la LLA en adultos está aumentando exponencialmente», según dicho experto y primer autor de la recomendación de referencia.
Las recomendaciones detalladas de la ELN tienen como objetivo no sólo brindar a los médicos interesados respuestas a las preguntas más importantes relacionadas con el manejo de pacientes, sino también ayudar a estandarizar la presentación de informes de ensayos clínicos.
El grupo de la ELN había identificado una necesidad insatisfecha de orientación sobre el tratamiento de la LLA en adultos, desde el diagnóstico hasta el postratamiento. Al respecto, como indican, la inmunoterapia está cada vez más integrada en las terapias de primera línea, mientras que la gestión de las recaídas sigue siendo un reto considerable. Los enfoques terapéuticos deben adaptarse a subgrupos específicos y la gestión práctica supone un reto en situaciones específicas como la leucemia secundaria.
Principales líneas
Divididas en dos partes las nuevas recomendaciones, la primera trata sobre los diagnósticos, factores de pronóstico y evaluaciones de respuesta, y también define estándares para la clasificación y evaluación en ensayos clínicos.
Al respecto, los autores consideran esencial definir procedimientos diagnósticos fiables y rentables para mejorar la clasificación de la LLA. Sobre esta base, la futura estratificación del riesgo podrá integrar marcadores moleculares, posibles dianas terapéuticas, riesgos de recaída y toxicidades, entre otros aspectos.
Mientras, la segunda parte cubre todo el tratamiento y abarca desde la terapia de inducción y consolidación hasta el uso de nuevas sustancias, el trasplante de células madre, la terapia de recaída, el tratamiento de subgrupos especiales de LLA, los efectos tardíos de la terapia y el tratamiento de apoyo. Además de una evaluación detallada de los datos disponibles, las recomendaciones también contienen valoraciones de expertos sobre los temas que se debaten actualmente.
01 marzo 2024| Fuente: IMMédico | Tomado de | Noticia

