jul
6
 Investigadores españoles han descrito la función clave que desempeña una proteína en el proceso de meiosis, la división celular que origina óvulos o espermatozoides en los mamíferos y que es clave para asegurar la diversidad genética y su estabilidad entre generaciones.
Investigadores españoles han descrito la función clave que desempeña una proteína en el proceso de meiosis, la división celular que origina óvulos o espermatozoides en los mamíferos y que es clave para asegurar la diversidad genética y su estabilidad entre generaciones.
Un equipo científico del Centro de Investigación del Cáncer -centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad de Salamanca (USAL)- ha descrito una nueva función de una enzima en ese proceso y han publicado los resultados de su trabajo en la revista Proceedings of the National Academy of Sciences (PNAS).
Los hallazgos que han logrado los científicos abren nuevas vías para la investigación sobre los mecanismos moleculares de la meiosis y sus posibles implicaciones en la fertilidad y en las enfermedades genéticas, ha informado el Consejo Superior de Investigaciones Científicas.
Las células humanas y animales son “diploides”, es decir que proceden de la fusión de dos gametos que tienen 23 pares de cromosomas cada una (espermatozoide y óvulo).
«La producción de los gametos o células sexuales es uno de los procesos más complejos que ocurren durante el desarrollo y requiere de una forma de división celular altamente especializada denominada meiosis», ha explicado Alberto Martín Pendás, investigador del CIC y uno de los autores del estudio.
Durante esta división se reduce el número de cromosomas a la mitad (23 cromosomas) creando espermatozoides y óvulos a partir de células progenitoras diploides (46 cromosomas).
«Para repartir exactamente a la mitad el contenido cromosómico a cada gameto, las células utilizan un mecanismo muy fiable, en el que cada cromosoma encuentra y se une a su pareja, asegurando de esta forma su ulterior reparto equitativo», añade el científico.
La investigadora Elena Llano, profesora del departamento de Fisiología de la Universidad de Salamanca y autora también del estudio, ha subrayado que el control exhaustivo de los mecanismos implicados en este delicado proceso es fundamental.
Si se producen errores se pueden producir abortos espontáneos e infertilidad o pueden causar enfermedades genéticas, como el síndrome de Down, en el que uno de los gametos aporta 2 copias del cromosoma del par 21, en vez de solo uno, dando lugar a un individuo con 47 cromosomas, ha explicado la investigadora.
«Este trabajo de investigación no solo mejora nuestra comprensión de la meiosis, sino que también subraya la complejidad de los procesos que aseguran la segregación precisa de los cromosomas y la generación de gametos viables», ha añadido Yazmine Bejarano Condezo, coautora del estudio.
Por todo ello, han asegurado los científicos, estas nuevas aportaciones pueden allanar el camino para establecer nuevas estrategias que permitan abordar los desafíos reproductivos y las enfermedades genéticas.
04 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
3
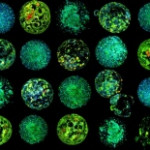 Una nueva tecnología no invasiva es capaz de visualizar el metabolismo de embriones obtenidos por fecundación ‘in vitro’ para decidir cuál tiene más posibilidades de implantarse correctamente en el útero y llegar a término.
Una nueva tecnología no invasiva es capaz de visualizar el metabolismo de embriones obtenidos por fecundación ‘in vitro’ para decidir cuál tiene más posibilidades de implantarse correctamente en el útero y llegar a término.
Se trata de una técnica -probada en ratones- más precisa y fiable que los métodos tradicionales y detrás de ella está el equipo de Bioingeniería en Salud Reproductiva del Instituto de Bioingeniería de Cataluña (IBEC).
El método, bautizado como Metaphor y cuya descripción se publica en la revista PNAS, genera imágenes 3D revelando los colores presentes en el embrión de forma totalmente no invasiva, y usa además inteligencia artificial.
Ciertos compuestos naturalmente fluorescentes del metabolismo de los embriones son clave en procesos como la respiración celular o el consumo de nutrientes, con lo cual Metaphor permite observar de manera fiable el estado de salud del embrión, señala un comunicado del IBEC.
«Esta nueva tecnología ayudará a aumentar la probabilidad de éxito en procesos de reproducción asistida, reduciendo el llamado ‘tiempo hasta el embarazo’, y el desgaste económico y psicológico de las pacientes», destaca Samuel Ojosnegros.
El trabajo describe cómo, en estudios con ratones, se logró duplicar la tasa de acierto al seleccionar embriones viables en comparación con embriólogos que usan microscopía tradicional.
Además del análisis de embriones, el método tiene una gran precisión para analizar el metabolismo de ovocitos, permitiendo seleccionar los más aptos para ser fecundados ‘in vitro’.
El sistema Metaphor discriminó entre ovocitos jóvenes o no con un 96 % de precisión y pudo predecir cuales se desarrollarían en embriones viables con más de un 80 % de precisión, «unos números sin precedentes en el campo».
«Somos capaces de evaluar la pérdida de calidad de los ovocitos asociada a la pérdida de fertilidad con la edad. Buscamos lo que se conoce como ‘firmas moleculares’, características de las células asociadas a esta pérdida de fertilidad, como por ejemplo la distribución de mitocondrias», detalla Anna Seriola, también autora del estudio.
La base tecnológica de Metaphor emplea métodos de inteligencia artificial (IA) para analizar las imágenes metabólicas que se obtienen mediante microscopía hiperespectral.
Mediante esta microscopía se capturan cientos de imágenes que contienen información compleja de muchos metabolitos mezclados de embriones y ovocitos.
Para analizarlos se ha entrenado una herramienta de IA capaz de analizar y clasificar estas imágenes en cuestión de minutos, detalla por su parte Albert Parra.
Actualmente, los investigadores ya están ajustando esta revolucionaria tecnología para evaluar embriones humanos y han incorporado una ‘spin-off’ (empresa) que en los próximos años la podría llevar a las clínicas de reproducción asistida.
01 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
26
 Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Un estudio con investigadores del Centro Andaluz de Biología del Desarrollo (CABD) ha permitido identificar diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina, lo que profundiza en las causas y el tratamiento de la ceguera más extendida en Europa.
Según ha informado este lunes el Centro Superior de Investigaciones Científicas (CSIC), las enfermedades hereditarias de la retina representan la mayor causa de ceguera en el continente europeo, un problema que afecta a 350 000 personas.
Estas enfermedades han sido consideradas incurables durante mucho tiempo ya que se pensaba que la pérdida de visión debido a estas condiciones era irreversible.
Sin embargo, recientemente ha habido un gran interés en el avance de tratamientos novedosos en esta área, por lo que varios grupos de investigación interesados en estas enfermedades se han reunido en una red europea para saber más sobre este tipo de afecciones.
La correcta visión depende de la interacción entre los dos componentes que forman la retina: la retina neural y el epitelio pigmentado.
Aunque las cegueras progresivas convergen finalmente en la degeneración de los denominados ‘fotorreceptores’, frecuentemente están asociadas a la activación de genes exclusivamente en uno de los dos componentes.
En la última década, se ha evidenciado que la actividad de los genes está regulada por la estructura tridimensional del genoma.
En el trabajo, se ha comparado esa estructura tridimensional de los genomas de la retina neural y el epitelio pigmentado, lo que ha permitido la identificación de diferencias asociadas a la activación específica de genes implicados en trastornos hereditarios de la retina.
Hasta hace poco el estudio genético de este tipo de enfermedades se centraba en alteraciones en las regiones denominadas «codificantes», es decir las zonas del genoma que albergan los genes que dan lugar a las proteínas.
El problema es que muchos de los pacientes no presentan variaciones en estas regiones, lo que sugiere fallos estructurales en el genoma como potencial causa de estas enfermedades.
Los datos analizados en este proyecto ayudan a definir los paisajes regulatorios de los genes expresados en los compartimentos de la retina neural y el epitelio pigmentado en humanos.
Estas conclusiones ofrecen una referencia «muy importante» para predecir posibles variantes estructurales hereditarias que ayuden en ciertos casos a entender las bases moleculares de su ceguera y mejoren el consejo genético en familiares que aún no han desarrollado la enfermedad.
24 junio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
15
 A 10 años de celebrarse en esta fecha el Día Internacional de Sensibilización sobre el Albinismo, continúan los esfuerzos por garantizar los derechos y eliminar la discriminación de personas con este trastorno de salud.
A 10 años de celebrarse en esta fecha el Día Internacional de Sensibilización sobre el Albinismo, continúan los esfuerzos por garantizar los derechos y eliminar la discriminación de personas con este trastorno de salud.
Establecida por resolución de las Asamblea General de las Naciones Unidas (ONU) en 2014, cada 13 de junio se conmemora esta efeméride que pretende crear conciencia mundial, así como evitar el maltrato y discriminación hacia las personas albinas, y acabar con el estigma y falsas creencias sobre esta condición, donde la superstición y el fanatismo no tienen cabida.
En esta jornada, la ONU destacó los incansables esfuerzos de los grupos de albinismo de todo el mundo y, a la par, instó a reflexionar sobre los continuos cambios jurídicos, políticos y prácticos que aún son necesarios para garantizar el disfrute pleno e igualitario de los derechos de las personas con albinismo.
Según los expertos, este es un trastorno poco frecuente, no contagioso, hereditario y congénito.
En casi todos los tipos de albinismo, ambos progenitores deben ser portadores del gen para que se transmita el trastorno, aunque ellos mismos no lo presenten.
Se da en ambos sexos, es independiente del origen étnico y puede existir en cualquier territorio.
Se caracteriza por la ausencia de pigmentación (melanina) en la piel, el cabello y los ojos, lo que causa sensibilidad al sol y a la luz intensa, y provoca que casi todas las personas con albinismo padezcan deficiencias visuales y sean propensas a sufrir cáncer de piel.
Los especialistas estiman que en América del Norte y Europa una de cada 17 000 a 20 000 personas presenta algún tipo de albinismo.
En tanto, la afección es mucho más común en África subsahariana, donde se cree que una de cada 1 400 personas está afectada en Tanzania y hay prevalencias de hasta uno de cada 1000 individuos en ciertas poblaciones de Zimbabwe y otros grupos étnicos concretos en África Meridional.
La falta de melanina en los albinos hace que sean extremadamente vulnerables al cáncer de piel, por lo que en algunos países la mayoría de ellos muere por esta causa entre los 30 y los 40 años de edad.
Si pudieran ejercer plenamente su derecho a la salud, los albinos podrían tratarse de este tipo de cáncer ya que es prevenible en un alto porcentaje —con revisiones médicas regulares, protectores solar, gafas de sol y ropa de protección solar— sin embargo, en muchas naciones no tienen acceso a estos recursos ya que se encuentran fuera del sistema.
13 junio 2024|Fuente: Prensa Latina |Tomado de |Noticia
jun
8
 El síndrome de las piernas inquietas motiva una irrefrenable necesidad de moverlas y puede alterar gravemente la vida de las personas que lo sufren; un equipo de científicos ha descubierto ahora las causas que se esconden tras ese trastorno y han apuntado posibles formas de tratarlo.
El síndrome de las piernas inquietas motiva una irrefrenable necesidad de moverlas y puede alterar gravemente la vida de las personas que lo sufren; un equipo de científicos ha descubierto ahora las causas que se esconden tras ese trastorno y han apuntado posibles formas de tratarlo.
Los investigadores, que hoy publican las conclusiones de su trabajo en Nature Genetics, han descubierto las pistas genéticas que están detrás del síndrome, una afección frecuente entre las personas mayores, y su hallazgo podría además ayudar a identificar a los individuos con mayor riesgo de padecerlo y las posibles maneras de combatirlo.
El síndrome de las piernas inquietas, resume hoy la revista, puede provocar una desagradable sensación de arrastre en las piernas y una necesidad imperiosa de moverlas, y aunque algunas personas experimentan los síntomas sólo ocasionalmente, otras los padecen todos los días y esos síntomas suelen empeorar al atardecer o por la noche y alterar gravemente el sueño.
A pesar de que esta afección es relativamente frecuente -uno de cada 10 ancianos experimenta síntomas y hasta el 3 por ciento se ven gravemente afectados y buscan ayuda médica-, se sabe poco sobre sus causas, pero sí que estas personas suelen padecer otras afecciones, como depresión o ansiedad, trastornos cardiovasculares, hipertensión y diabetes, aunque se desconoce el motivo.
Estudios anteriores habían identificado 22 «localizaciones» de riesgo genético, regiones del genoma que contienen cambios asociados a un mayor riesgo de desarrollar la afección, pero no se conocen todavía «biomarcadores» -firmas genéticas- que puedan utilizarse para diagnosticar objetivamente la enfermedad.
Comprender la base genética para mejorar el tratamiento
Ahora, un equipo internacional dirigido por investigadores del Instituto Helmholtz de Neurogenómica de Múnich, el Instituto de Genética Humana de la Universidad Técnica de Múnich (TUM) y la Universidad de Cambridge reunió y analizó los datos de tres estudios de asociación del genoma completo.
Compararon el ADN de pacientes y controles sanos para buscar las diferencias más frecuentes en los afectados por el síndrome de las piernas inquietas, y al combinar los datos, el equipo creó un potente conjunto de datos con más de 100 000 pacientes.
El investigador Steven Bell, de la Universidad de Cambridge, ha destacado que el estudio es el mayor de su clase sobre este trastorno, y ha asegurado que «al comprender las bases genéticas del síndrome de las piernas inquietas, esperamos encontrar mejores formas de controlarlo y tratarlo, lo que podría mejorar la vida de muchos millones de personas afectadas en todo el mundo».
El equipo identificó más de 140 nuevas «localizaciones» genéticas de riesgo, multiplicando por ocho el número conocido, incluidos tres en el cromosoma X, y no encontró diferencias genéticas marcadas entre hombres y mujeres, a pesar de que la enfermedad es dos veces más común en las mujeres que en los hombres, lo que sugiere que una compleja interacción de la genética y el medio ambiente (incluidas las hormonas) puede explicar las diferencias de género que se observan en la vida real.
Dos de las diferencias genéticas identificadas por el equipo afectan a genes conocidos como receptores del «glutamato 1 y 4″, importantes ambos para la función nerviosa y cerebral.
Esos receptores podrían ser el objetivo de algunos fármacos que ya existen o utilizarse para desarrollar otros nuevos, han apuntado los investigadores, y han asegurado que los primeros ensayos ya han mostrado respuestas positivas a esos medicamentos en pacientes con síndrome de piernas inquietas.
Los investigadores han subrayado además que sería posible utilizar información básica como la edad, el sexo y los marcadores genéticos para clasificar con precisión quién tiene más probabilidades de padecer síndrome de piernas inquietas grave en nueve de cada diez casos.
Emplearon además diversas técnicas para entender cómo puede afectar el síndrome de piernas inquietas a la salud en general y la información genética para examinar las relaciones causa-efecto, y los resultados revelaron que el síndrome aumenta el riesgo de desarrollar diabetes.
Aunque se cree que unos niveles bajos de hierro en la sangre son desencadenantes del síndrome de las piernas inquietas, los investigadores no hallaron vínculos genéticos sólidos con el metabolismo del hierro, aunque han corroborado que tampoco pueden descartarlo por completo como un factor de riesgo.
05 junio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
6
 El mundo celebra hoy el Día Mundial de la Fertilidad con un llamamiento a la temprana atención médica en cuestiones de concepción biológica, pues cada vez son más frecuentes los problemas para tener hijos de esta forma.
El mundo celebra hoy el Día Mundial de la Fertilidad con un llamamiento a la temprana atención médica en cuestiones de concepción biológica, pues cada vez son más frecuentes los problemas para tener hijos de esta forma.
Según la Organización Mundial de la Salud, la infertilidad, que afecta a un gran porcentaje de parejas en edad reproductiva, ocurre cuando no se produce un embarazo pasado un año de relaciones sexuales sin utilización de métodos anticonceptivos, o bien cuando hay una dificultad para mantener un embarazo.
Esa enfermedad crónica que puede darse tanto en hombres como en mujeres y las causas son de origen diverso.
Varios estudios refieren que en las féminas la infertilidad puede estar ocasionada por falta de ovulación o mala calidad de los óvulos, padecer de endometriosis, que es el crecimiento del tejido del interior del útero, fuera de éste, en las trompas de Falopio o en los ovarios.
Además de la presencia de fibromas uterinos o las trompas de Falopio bloqueadas.
En hombres, las causas pueden ser un bajo recuento de espermatozoides en el semen, o ausencia de ellos; una baja movilidad de los espermatozoides o que estos no se han formado adecuadamente.
También puede estar condicionada por poseer semen espeso que no permite llegar a los espermatozoides al óvulo, problemas hormonales o de eyaculación.
De manera general, el sobrepeso u obesidad, la contaminación ambiental, el consumo de tabaco o alcohol, la diabetes o haber estado en tratamiento contra el cáncer o la edad avanzada también son algunas de las causas de la disminución de la fertilidad en el mundo.
Análisis epidemiológicos recientes señalan que la infertilidad afecta a 15 % de la población en edad reproductiva en países occidentales.
Sin embargo, los avances en la medicina han permitido tener hijos con métodos como la Inseminación Artificial, una técnica de fertilidad muy sencilla y rápida, indicada en mujeres jóvenes con una buena reserva ovárica y con un tiempo de esterilidad corto de un año o un año y medio.
A esa posibilidad se suma la Fecundación in Vitro (FIV), principal tratamiento cuando otras técnicas de reproducción asistida no han tenido éxito, y que consiste en unir en el laboratorio el óvulo con los espermatozoides, y transferir el embrión seleccionado al útero materno.
También las parejas pueden optar por el Diagnóstico Genético Preimplantacional (DGP) es una técnica de reproducción asistida que permite detectar los embriones libres de anomalías cromosómicas antes de ser transferidos al útero de la madre.
Para aquellas mujeres que deciden retrasar su maternidad por motivos personales, familiares o profesionales, existe la criopreservación ovocitaria, proceso por el cual se extraen y se vitrifican una serie de óvulos no fecundados con el objetivo de preservar la fertilidad.
El Día Mundial de la Fertilidad se celebra el 4 de junio de cada año desde 2009, y la elección de esta fecha es debido a la relación de los números 4 y 6, que simbolizan los días de la existencia de un embrión humano antes de que, por fecundación in vitro, por ejemplo, se implante en el útero de su madre.
04 junio 2024|Fuente: Prensa Latina |Tomado de |Noticia

