jun
15
 A 10 años de celebrarse en esta fecha el Día Internacional de Sensibilización sobre el Albinismo, continúan los esfuerzos por garantizar los derechos y eliminar la discriminación de personas con este trastorno de salud.
A 10 años de celebrarse en esta fecha el Día Internacional de Sensibilización sobre el Albinismo, continúan los esfuerzos por garantizar los derechos y eliminar la discriminación de personas con este trastorno de salud.
Establecida por resolución de las Asamblea General de las Naciones Unidas (ONU) en 2014, cada 13 de junio se conmemora esta efeméride que pretende crear conciencia mundial, así como evitar el maltrato y discriminación hacia las personas albinas, y acabar con el estigma y falsas creencias sobre esta condición, donde la superstición y el fanatismo no tienen cabida.
En esta jornada, la ONU destacó los incansables esfuerzos de los grupos de albinismo de todo el mundo y, a la par, instó a reflexionar sobre los continuos cambios jurídicos, políticos y prácticos que aún son necesarios para garantizar el disfrute pleno e igualitario de los derechos de las personas con albinismo.
Según los expertos, este es un trastorno poco frecuente, no contagioso, hereditario y congénito.
En casi todos los tipos de albinismo, ambos progenitores deben ser portadores del gen para que se transmita el trastorno, aunque ellos mismos no lo presenten.
Se da en ambos sexos, es independiente del origen étnico y puede existir en cualquier territorio.
Se caracteriza por la ausencia de pigmentación (melanina) en la piel, el cabello y los ojos, lo que causa sensibilidad al sol y a la luz intensa, y provoca que casi todas las personas con albinismo padezcan deficiencias visuales y sean propensas a sufrir cáncer de piel.
Los especialistas estiman que en América del Norte y Europa una de cada 17 000 a 20 000 personas presenta algún tipo de albinismo.
En tanto, la afección es mucho más común en África subsahariana, donde se cree que una de cada 1 400 personas está afectada en Tanzania y hay prevalencias de hasta uno de cada 1000 individuos en ciertas poblaciones de Zimbabwe y otros grupos étnicos concretos en África Meridional.
La falta de melanina en los albinos hace que sean extremadamente vulnerables al cáncer de piel, por lo que en algunos países la mayoría de ellos muere por esta causa entre los 30 y los 40 años de edad.
Si pudieran ejercer plenamente su derecho a la salud, los albinos podrían tratarse de este tipo de cáncer ya que es prevenible en un alto porcentaje —con revisiones médicas regulares, protectores solar, gafas de sol y ropa de protección solar— sin embargo, en muchas naciones no tienen acceso a estos recursos ya que se encuentran fuera del sistema.
13 junio 2024|Fuente: Prensa Latina |Tomado de |Noticia
jun
7
 El Premio Princesa de Asturias de Investigación Científica fue anunciado hoy en Oviedo, donde el jurado galardonó a expertos que desarrollaron fármacos contra la diabetes y la obesidad.
El Premio Princesa de Asturias de Investigación Científica fue anunciado hoy en Oviedo, donde el jurado galardonó a expertos que desarrollaron fármacos contra la diabetes y la obesidad.
Los especialistas proceden de Estados Unidos, Canadá y Dinamarca, considerados referentes mundiales en el campo de la endocrinología. Son ellos, Daniel J. Drucker, Jeffrey M. Friedman, Joel F. Habener, Jens Juul Holst y Svetlana Mojsov.
«Las investigaciones de los científicos laureados han establecido las bases endocrinas de la diabetes y la obesidad, patologías prominentes que son un problema global de salud pública sin tratamiento efectivo hasta la fecha», destacó el jurado.
En un primer momento, los científicos desarrollaron un tratamiento para la diabetes, el cual posteriormente se aplicó con éxito a la lucha contra la obesidad y el sobrepeso. También, resultó útil frente a patologías asociadas, a la sazón cardiovasculares.
De forma separada, aunque con un nivel de coordinación e intercambio de criterios, Habener y Drucker desde Estados Unidos, y de forma paralela la bioquímica Mojsov, se enfocaron en nuevos tipos de hormonas intestinales relacionadas con la obesidad.
En tanto, en Holst descubrió en la Universidad de Copenhague que los niveles de insulina se disparaban y los niveles de azúcar disminuían en pacientes sometidos a una cirugía intestinal y relacionó esos cambios con varias hormonas.
05 junio 2024|Fuente: Prensa Latina |Tomado de |Noticia
may
2
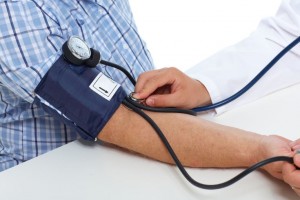 Un equipo internacional de investigadores ha descubierto más de cien nuevas regiones del genoma humano (o loci), que parecen influir en la tensión arterial de una persona.
Un equipo internacional de investigadores ha descubierto más de cien nuevas regiones del genoma humano (o loci), que parecen influir en la tensión arterial de una persona.
Además, varios de ellos pueden ser relevantes para el metabolismo del hierro y un tipo de receptor celular conocido como receptores adrenérgicos.
El estudio, liderado por los Institutos Nacionales de la Salud estadounidenses (NIH) y el Instituto Nacional de Investigación del Genoma Humano (NHGRI) y publicado este martes en la revista Nature Genetics, es uno de los mayores estudios genómicos sobre la presión arterial realizados hasta la fecha, con datos de más de un millón de participantes.
Los resultados servirán para comprender mejor cómo se regula la presión arterial y encontrar posibles nuevas dianas farmacológicas.
«Nuestro estudio ayuda a explicar una proporción mucho mayor de las diferencias entre la presión arterial de dos personas de lo que se sabía hasta ahora», dice Jacob Keaton, científico del NHGRI y primer autor del estudio.
Además, «conocer el riesgo de una persona de desarrollar hipertensión podría conducir a tratamientos a medida, que tienen más probabilidades de ser eficaces», puntualiza.
Para comprender la genética de la presión arterial, el equipo combinó cuatro grandes conjuntos de datos procedentes de estudios de asociación de todo el genoma de la presión arterial y la hipertensión.
Tras analizar los datos, hallaron más de 2 000 loci genómicos relacionados con la presión arterial, incluidas 113 regiones nuevas.
Entre los loci genómicos recién descubiertos, varios residen en genes que desempeñan un papel en el metabolismo del hierro, lo que confirma estudios anteriores según los cuales los niveles elevados de hierro acumulado pueden contribuir a las enfermedades cardiovasculares.
El equipo también confirmó la asociación entre las variantes del gen ADRA1A y la presión arterial.
ADRA1A codifica un tipo de receptor celular, denominado receptor adrenérgico, que actualmente es diana de la medicación contra la tensión arterial, lo que sugiere que otras variantes genómicas descubiertas en el estudio también pueden tener el potencial de ser dianas farmacológicas para alterar la tensión arterial.
«Este estudio demuestra que estos grandes estudios de asociación de todo el genoma tienen relevancia clínica para encontrar nuevas dianas farmacológicas y son necesarios para descubrir más dianas farmacológicas a medida que avanzamos», defiende Keaton.
A partir de estos análisis, los investigadores pudieron calcular una puntuación de riesgo poligénico, que combina los efectos de todas las variantes genómicas para predecir la presión arterial y el riesgo de hipertensión.
Estas puntuaciones de riesgo poligénico pueden ser una herramienta útil en la medicina de precisión, pero se necesitan datos genómicos más diversos para que puedan aplicarse ampliamente en la atención sanitaria rutinaria.
Aunque los datos recopilados procedían en su mayoría de personas de ascendencia europea, los investigadores descubrieron que las puntuaciones de riesgo poligénico también eran aplicables a personas de ascendencia africana.
Casi la mitad de los adultos de Estados Unidos padecen presión arterial alta o hipertensión, una dolencia que suele ser hereditaria, lo que significa que, junto al estilo de vida (sendentarismo, tabaquismo o estrés) y la dieta, hay un componente genético en el desarrollo de esta afección.
Cuando la tensión arterial es demasiado alta de forma constante, puede dañar el corazón y los vasos sanguíneos del cuerpo y provocar cardiopatías, enfermedades renales, accidentes cerebrovasculares y otras afecciones.
30 abril 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
abr
24
 Actualmente existen alrededor de 6 313 enfermedades raras identificadas, aunque esta cifra es variable ya que, según ha asegurado el miembro de la junta directiva de la Federación Española de Enfermedades Raras (FEDER), Daniel de Vicente, «todavía hay más de 7 000 enfermedades en el mundo que pueden ser catalogadas como poco frecuentes», pero, de todas ellas, solo el 6 % por ciento disponen de un tratamiento eficaz.
Actualmente existen alrededor de 6 313 enfermedades raras identificadas, aunque esta cifra es variable ya que, según ha asegurado el miembro de la junta directiva de la Federación Española de Enfermedades Raras (FEDER), Daniel de Vicente, «todavía hay más de 7 000 enfermedades en el mundo que pueden ser catalogadas como poco frecuentes», pero, de todas ellas, solo el 6 % por ciento disponen de un tratamiento eficaz.
«Todas las enfermedades raras carecen muchas veces de un conocimiento estricto por parte de los profesionales y hay una falta de investigación en todas ellas. Esto conlleva que el número de terapias sea muy reducido y que solo el 6 % de estas enfermedades tengan un tratamiento eficaz. Esto tiene un gran impacto en la calidad de vida de los pacientes y sus familias ya que muchas son degenerativas», ha explicado Daniel de Vicente durante una jornada sobre la situación actual de las enfermedades raras, organizada por la Fundación Ramón Areces con el Centro
de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y FEDER.
Durante la jornada los expertos han coincidido en que en España existe una falta de acceso y equidad a las terapias y tratamientos existentes ya que, de los 147 medicamentos huérfanos autorizados en Europa, solo 78 están financiados en España y el tiempo medio de acceso a las terapias es de 23 meses, según ha aseverado Daniel de Vicente recalcando que es «una situación compleja».
En este sentido, el presidente de FEDER, Juan Carrión, ha incidido en la necesidad de seguir investigando las enfermedades raras para poder diagnosticarlas y tratarlas a tiempo ya que, «de las más de 6 000 enfermedades raras identificadas, solo el 30 % de estas enfermedades se investigan, se invierte el 1,43 % del Producto Interno Bruto (PIB) en investigación de enfermedades raras, un 1,28 % por debajo de otros países».
«Hay que garantizar acceso a los tratamientos ya que esto no es una realidad porque supeditamos el acceso al código postal de residencia del paciente ya que, hasta en una misma comunidad autónoma, hay diferencias entre los hospitales que disponen o no del medicamento. Hay una necesidad de abordar un Plan de Acción a nivel estatal», ha afirmado Carrión señalando que, al día de hoy, «solo hay siete CCAA que disponen de un Plan de Atención Integral o estrategias» y que se necesita «presupuesto para que estos planes se lleven a cabo».
INTELIGENCIA ARTIFICIAL Y GENÓMICA DE PRECISIÓN: LA CLAVE DEL FUTURO
Una de las claves del futuro del diagnóstico y tratamiento de las enfermedades raras reside en la genómica de precisión ya que el 80 % de estas enfermedades tienen un origen genético. Por ello, los expertos han insistido en la necesidad de que España disponga de una especialidad de genética, que a día de hoy no existe en el SNS, a diferencia del resto de países de Europa que sí que tienen la especialidad de genética.
La aplicación de la Inteligencia Artificial supone un gran reto en el diagnóstico y tratamiento de las enfermedades raras en muchos aspectos ya que, por ejemplo, «tiene un gran potencial en la clasificación de las enfermedades raras», un aspecto crucial que a día de hoy no se consigue porque «si no se sabe cuantas enfermedades hay, es imposible clasificarlas», aunque el uso de la IA siempre debe acompañarse ‘de la supervisión de un especialista», tal y como ha explicado el miembro del Instituto de Genética Médica y Molecular, Hospital La Paz, Julián Nevado.
«La IA ayudará para automatizar la resolución de problemas, mejorar la capacidad de tomar decisiones, caracterizar de forma más precisa los estados de salud, incluyendo las EERR. Necesitamos mejorar la precisión en diagnóstico pero también la clasificación de las enfermedades. Siempre bajo la supervisión de los profesionales sanitarios», ha indicado Julián Nevado.
Por su parte, la biología molecular y el uso de las tecnologías genómicas también son esenciales y pueden tener muchas ventajas en las enfermedades raras ya que permiten agilizar el diagnóstico e implementar tratamientos más personalizados.
En este sentido, los expertos han apuntado a la metagenómica, cuya base principal está en la biología molecular, y que pretende no centrarse en el organismo individual, sino en la microbiología, en el ADN y ARN presente en su hábitat natural como el intestino humano.
El uso de la metagenómica en enfermedades raras permite identificar microorganismos presentes en muestras clínicas, como heces o saliva, que podrían estar relacionados con la enfermedad poco frecuente; estudiar el microbioma intestinal y su posible influencia en la enfermedad poco frecuente; ayudar en la identificación de biomarcadores microbianos o genéticos asociados con estas EERR, que podrían usarse para el diagnóstico temprano, la estratificación de pacientes o el monitoreo de la progresión de la enfermedad.
«Con la genómica podemos abarcar muchas de las enfermedades genéticas. Tendríamos que estar más centrados en los procesos y generar una cartera de diagnósticos que nos ayude en los pacientes. Es un proceso complejo, hay que tener investigaciones y validación sólidas y hay que integrar nuevos perfiles de profesionales ya que para la genómica necesitamos bioinformáticos para interpretar y analizadores de datos», ha
señalado Nevado
Entre los avances terapéuticos también destacan los avances bioquímicos para el diagnóstico de las EERR que incluyen: la secuenciación masiva del estudio del genoma, que ha tenido un desarrollo exponencial en los últimos años siendo más eficiente, rápida y barata; las terapias CRISPR-CAS, que consisten en se trata de una tecnología de «edición genética» con enorme potencial, inicialmente como herramienta terapéutica; y, por último, los marcadores bioquímicos, que permiten monitorizar las respuestas a los tratamientos y agilizar el diagnóstico.
Asimismo, destacan los avances en los diagnósticos por imagen que, aunque en los últimos años «no ha salido una tecnología mejor que la resonancia magnética», esta técnica «ha mejorado mucho en los últimos años» y «sigue siendo la reina», según ha asegurado la neuropediatra del Hospital Universitario Central de Asturias, Raquel Blanco.
Así, la doctora Blanco ha detallado que las técnicas de RM ahora son «mucho más finas y con mayor resolución» ya que cada vez se obtienen mejores imágenes en un menor tiempo. Entre las técnicas destaca la resonancia PET-TC que permite el diagnóstico de algunas enfermedades raras como la encefalitis en un menor tiempo posible.
PROGRAMA DE PATOLOGÍAS POCO FRECUENTES
Durante el encuentro, la Fundación Ramón Areces ha anunciado un nuevo programa específico orientado a las patologías poco frecuentes en el que financiará un proyecto de investigación transversal y multidisciplinario que incluirá una dotación específica para laboratorios en enfermedades raras. También se dotará económicamente de 10 o 12 becas predoctorales para aquellos estudiantes que, habiendo acabado la
carrera, quieran realizar una tesis doctoral en este campo, según ha explicado el presidente del Consejo Científico de la Fundación, Emilio Bouza.
Dentro de ese compromiso con las patologías poco frecuentes, también se celebrará todos los años una jornada como la de este martes para poder conocer la evolución de la investigación en estas dolencias.
23 abril 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
nov
3
 Una investigación puntera en terapia génica, basada en el sistema de edición genética CRISPR-Cas9, permite insertar genes con precisión, lo que ofrece esperanzas para muchos trastornos genéticos como la inmunodeficiencia combinada grave (IDCG), que afecta a los lactantes. La investigación, cuyos detalles se publican este viernes en la revista Nature Communications, ha sido realizada por científicos de la Universidad Bar-Ilan de Israel.
Una investigación puntera en terapia génica, basada en el sistema de edición genética CRISPR-Cas9, permite insertar genes con precisión, lo que ofrece esperanzas para muchos trastornos genéticos como la inmunodeficiencia combinada grave (IDCG), que afecta a los lactantes. La investigación, cuyos detalles se publican este viernes en la revista Nature Communications, ha sido realizada por científicos de la Universidad Bar-Ilan de Israel.
La IDCG es un grupo de enfermedades hereditarias del sistema inmunitario causadas por mutaciones genéticas que provocan anomalías en los linfocitos T y linfocitos B, dos tipos de glóbulos blancos necesarios para que el sistema inmune proteja al cuerpo de las infecciones. Si no se trata, la IDCG resulta mortal en el primer año de vida.
El tratamiento convencional consiste en un trasplante de sangre o de células madre hematopoyéticas (TCMH) para reconstruir el sistema sanguíneo del bebé, pero la dificultad de encontrar donantes compatibles y algunas complicaciones, como la enfermedad de injerto contra huésped (EICH), son importantes obstáculos.
Una solución innovadora ha surgido con la llegada de la edición del genoma mediante el uso de la tecnología CRISPR-Cas9, que ofrece esperanzas para muchos trastornos genéticos como la IDCG. El sistema CRISPR-Cas9 crea roturas de doble cadena específicas en el ADN, lo que permite la edición precisa de genes.
Este sistema de reparación puede alterar un gen específico o corregirlo, lo que permite atacar casi cualquier gen del genoma. Este avance abre la puerta a intervenciones terapéuticas para una amplia gama de enfermedades genómicas. El nuevo estudio presenta una prometedora técnica de edición genómica, la GE mediada por reparación homológica CRISPR-Cas9 (HDR), que ofrece la posibilidad de insertar genes con precisión. En ciertos subtipos de IDCG, una alternativa al tratamiento convencional (trasplante) puede ser la inserción genética convencional CRISPR-Cas9 mediada por HDR, pero conlleva riesgos inherentes, especialmente en los casos de IDCG causados RAG2.
RAG2 es una nucleasa que interviene en el corte del ADN durante el desarrollo de los linfocitos, y la inserción génica mediada por HDR CRISPR-Cas9 puede dar lugar a una actividad descontrolada de la nucleasa RAG2 y a variaciones estructurales perjudiciales. Para evitarlo, investigadores de la Universidad Bar-Ilan de Israel han propuesto una novedosa estrategia de sustitución, denominada ‘GE x HDR 2.0: Buscar y reemplazar’.
Este enfoque combina la edición del genoma mediada por CRISPR-Cas9 con vectores donantes de ADN adenoasociado recombinante de serotipo 6 (rAAV6) para sustituir con precisión la secuencia codificante de RAG2 y preservar los elementos reguladores. Esta estrategia puede aplicarse también a otros genes causantes de enfermedades. Para Ayal Hendel, de la Facultad de Ciencias de la Vida Goodman de la Universidad Bar-Ilan, esta técnica innovadora ‘aporta esperanza a los pacientes con RAG2-SCID y es prometedora para el tratamiento de otros trastornos genéticos’.
Referencia
Allen D, Knop O, Itkowitz B, Kalter N, Rosenberg M, Lancu O, et al. CRISPR-Cas9 engineering of the RAG2 locus via complete coding sequence replacement for therapeutic applications. Nat Commun[Internet]. 2023[citado 2 nov 2023]; 14(1): 6771. https://doi.org/10.1038/s41467-023-42036-5
2 noviembre 2023 |Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
may
16
Un equipo científico alemán ha desarrollado, por primera vez, modelos de ratones con un gen humano defectuoso responsable de una rara enfermedad genética: la hiperplasia suprarrenal congénita (HSC). El hallazgo, presentado en el XXV Congreso Europeo de Endocrinología que se está celebrando en Estambul, Turquía, puede ayudar a desarrollar nuevas terapias para personas con el tipo más común de esta patología congénita.
La HSC constituye un grupo de afecciones hereditarias que afecta aproximadamente a 1 de cada 15 000 nacimientos. En la forma más común, llamada deficiencia de 21-hidroxilasa, las mutaciones en el gen CYP21A2 hacen que las glándulas suprarrenales produzcan niveles bajos de cortisol y cantidades excesivas de hormonas andrógenas, como la testosterona. Este fenómeno conduce a una pubertad temprana, a que las niñas tengan rasgos masculinos y a varios problemas de salud, entre otros aspectos.
La terapia de reemplazo de hormonas esteroides es el tratamiento de primera línea, pero en muchas ocasiones puede originar efectos secundarios perjudiciales, lo que pone de manifiesto la necesidad de investigar más profundamente en la enfermedad y poder así establecer los tratamientos más efectivos y seguros.
En el hallazgo, los investigadores, del Hospital Universitario Carl Gustav Carus en Dresden, Alemania, reemplazaron el gen Cyp21a1 en ratones con el gen humano CYP21A2 portador de una mutación. Descubrieron que los ratones genéticamente modificados tenían, a las 20 semanas, glándulas suprarrenales agrandadas mientras expresaban el gen humano mutado. Además, y de manera similar a la enfermedad humana, la mutación provocó que tanto los ratones machos como las hembras tuvieran niveles bajos de corticosterona, la principal hormona del estrés en ratones que es equivalente al cortisol en humanos, y otros desequilibrios hormonales.
Aunque existen modelos animales de hiperplasia suprarrenal congénita, este es el primero en reproducir la condición humana en ratones y capaz de sobrevivir sin ningún tratamiento. «Nuestros modelos imitan con precisión los síntomas observados en pacientes humanos», según Shamini Ramkumar Thirumalasetty, coordinadora de la investigación, quien destaca que, por ejemplo, «los ratones hembra mutantes también tienen problemas de fertilidad, lo que creemos que probablemente se deba a los desequilibrios hormonales provocados por la hiperplasia suprarrenal congénita».
Este modelo de ratón abre una nueva vía que permitirá al equipo estudiar más detalladamente los mecanismos de la enfermedad y encontrar los tratamientos más efectivos.
La investigadora indica que aunque se están desarrollando nuevos tratamientos para minimizar los efectos secundarios de las hormonas esteroides, estos fármacos carecen de modelos ‘in vivo efectivos’ para las pruebas preclínicas. «Nuestro ratón puede servir como un excelente modelo para probar nuevos medicamentos y opciones de tratamiento para pacientes con hiperplasia suprarrenal congénita, como las terapias con células madre, y facilitará la transición de la investigación básica a la clínica».
Mayo 15/2023 (Diario Médico) – Tomado de Endocrinología – Presentado en el XXV Congreso Europeo de Endocrinología Copyright Junio 2018 Unidad Editorial Revistas, S.L.U. Todos los derechos reservados.


