ago
22
La Organización Mundial de la Salud (OMS) transmitió este martes un mensaje de tranquilidad ante el nuevo brote de mpox (conocida antes como viruela del mono) en África y un único caso detectado en Europa, en un intento por contener las informaciones alarmistas y rumores en torno a esta enfermedad y su modo de transmisión.
«El mpox no es la covid (…) En función de lo que sabemos, el mpox se transmite principalmente a través de contacto de piel con piel que presenta lesiones de mpox, incluidas (las producidas) en relaciones sexuales», señaló el director de OMS Europa, Hans Kluge.
En la misma línea, recordó que se sabe como controlar esta enfermedad infecciosa y cuales son «los pasos que se deben dar en Europa para eliminar la transmisión por completo».
En la misma rueda de prensa, el portavoz de la OMS, Tarik Jasarevic, enfatizó que no se recomienda el uso de mascarillas pues el contacto es de piel a piel.
La variante clado 1b se expande más rápido
El estado de alerta sanitaria que declaró la OMS hace unos días tiene que ver con la rápida expansión y elevada mortalidad de una nueva variante (denominada clado 1b) en África y un primer caso en Suecia, de un viajero que había estado en un área de África donde el virus circula con intensidad.
Esa variante es diferente al denominado clado 2, que causó en 2022 un violento brote en África y cientos de casos en Europa, Norteamérica y países de otras regiones.
El responsable de la oficina europea de la OMS recordó que hace dos años se pidió a los gobiernos de Europa que mantuviesen los esfuerzos para eliminar totalmente el mpox de Europa, pero se fracaso porque «hubo falta de compromiso y de recursos».
La consecuencia es que cada mes se diagnostican un centenar de casos de la clado 2 del mpox en Europa, con un total de 27 000 casos diagnosticados desde 2022 en este continente.
El clado 1b se contagia más fácilmente entre personas
Lo que preocupa del actual brote es que se está observando que el clado 1b se contagia más fácilmente entre personas y tiende a causar síntomas más severos.
Ante informaciones sobre la supuesta transmisión de este clado de mpox por el aire, el responsable sanitario explicó que «es posible que alguien, en la fase aguda de la infección y especialmente si tiene ampollas en la boca, pueda transmitir el virus a contactos cercanos a través de las gotitas (que exhala), en el hogar o en los hospitales».
La OMS ha señalado que hay evidencia importante de que también puede haber contagio mediante las sábanas y utensilios en hospitales.
Kluge admitió que el modo de transmisión del clado 1b todavía no está del todo claro y que se requieren más indagaciones.
El organismo de salud pública de África aborda el brote de mpox en la RDC
Por otro lado, el director general del organismo de salud pública de África, Jean Kaseya, se reunió en Kinshasa con el ministro de Sanidad congoleño, Roger Kamba, para abordar el brote de mpox originado en la República Democrática del Congo (RDC), informó la agencia de la Unión Africana (UA).
Los Centros para el Control y Prevención de Enfermedades de África (CDC de África) están «coordinando activamente la respuesta al virus del mpox en la RDC con varios socios», señaló el organismo en su perfil de la red social X.
Durante el encuentro entre sendas delegaciones y otros socios no especificados por los CDC de África, se trató el «plan de acción» para la gestión de la propagación de la enfermedad en el país centroafricano.
La RDC ha registrado en lo que va de año 16 700 casos y 570 muertes por mpox, que afecta principalmente a los más jóvenes, según las últimas cifras facilitadas por el Ministerio de Salud Pública, Higiene y Bienestar Social congoleño.
Kamba anunció el lunes en rueda de prensa que la RDC espera recibir más de tres millones de dosis de vacunas por parte de Japón, Bélgica y Estados Unidos.
Registrados casi 19 000 casos de mpox y 540 muertes en doce países de África en 2024
Desde la declaración el martes pasado del brote como emergencia de salud pública de importancia continental por parte de los CDC de África, el organismo ha observado 1 405 casos más y ninguna nueva muerte por mpox en los Estados miembros de la UA.
Aparte de la RDC, los otros países afectados son, por orden de incidencia, Burundi (con 572 casos y ninguna muerte), la República Centroafricana (263 casos, 0 muertes), la República del Congo o Congo-Brazzaville (169, 1), Nigeria (39, 0), Camerún (35, 2), Sudáfrica (24, 3), Liberia (5, 0), Ruanda (4, 0), Uganda (2, 0), Costa de Marfil (2, 0) y Kenia (1, 0).
De los 18 910 casos registrados hasta la fecha en el continente según los CDC de África, 3 154 han sido confirmados mediante pruebas clínicas y 15 756 son sospechas de infección.
En comparación con el mismo período de 2023, los contagios han aumentado un 104 %, mientras que las muertes son un 11 % más, subrayó Kaseya.
20 agosto 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
ago
8
 El Centro Europeo para la Prevención y Control de Enfermedades (ECDC, por sus siglas en inglés) ha registrado recientemente casos humanos de infección por el virus del Nilo Occidental (VNO) procedentes de Austria, Hungría y Rumanía, que se unen así a España, Francia, Italia y Grecia, que ya habían notificado casos en semanas anteriores.
El Centro Europeo para la Prevención y Control de Enfermedades (ECDC, por sus siglas en inglés) ha registrado recientemente casos humanos de infección por el virus del Nilo Occidental (VNO) procedentes de Austria, Hungría y Rumanía, que se unen así a España, Francia, Italia y Grecia, que ya habían notificado casos en semanas anteriores.
El primer caso notificado en países de la Unión Europea/Espacio Económico Europeo en 2024 se produjo en abril en España, concretamente en Sevilla, con un paciente que comenzó a desarrollar síntomas en marzo de 2024. Se notificaron casos adicionales con aparición de síntomas en junio y julio de 2024. En Italia, el primer caso de VNO se notificó en junio en la ciudad de Módena. Más tarde, el 5 de julio, Grecia notificó su primer caso de VNO de 2024.
En lo que respecta a España, este mismo lunes, la Consejería de Salud y Consumo de la Junta de Andalucía, a través de la Dirección General de Salud Pública y Ordenación Farmacéutica, confirmó nueve nuevos casos de VNO en dos personas de Los Palacios y Villafranca, otras tres de Dos Hermanas, otro par de Coria del Río y otro en La Puebla del Río; si bien seis de ellos ya se encuentran de alta.
Sin embargo, los casos ascienden a un número más elevado con toda seguridad, ya que, en la mayoría de las ocasiones, esta enfermedad cursa sin síntomas (80 % de los casos) o como un cuadro gripal por el que los pacientes no acuden al médico.
De hecho, de los 20 casos detectados en 2023, cinco se diagnosticaron porque eran personas donantes de sangre que desconocían estar infectadas, según informaron fuentes del Ministerio de Sanidad en el pasado mes de junio, en el marco de la presentación de la tercera parte de su ‘Plan de vigilancia, prevención y control de las enfermedades transmitidas por vectores’.
En humanos, el período de incubación va de dos a 14 días, aunque en inmunodeprimidos puede ser de hasta 21 días. En caso de producirse manifestaciones clínicas, estas pueden ser variadas, desde fiebre y mialgias hasta manifestaciones neurológicas graves. Estas últimas se producen en menos del 1 % de los infectados y pueden cursar con meningitis, encefalitis y/o parálisis flácida aguda.
La encefalitis es más frecuente que la meningitis. La parálisis flácida aguda es una presentación relativamente frecuente en personas jóvenes sanas. Puede haber afectación digestiva, y se han descrito, aunque con poca frecuencia, miocarditis, pancreatitis y hepatitis fulminante.
Según Sanidad, alrededor de un 10 % de las formas neurológicas pueden ser mortales, con mayor riesgo a mayor edad, en hombres, receptores de órgano sólido, si existe consumo excesivo de alcohol y quienes padecen diabetes, enfermedad renal crónica, enfermedad cardiovascular, hipertensión, cáncer o inmunosupresión. El riesgo de secuelas existe en el 30-60 por ciento de los casos con manifestaciones neurológicas.
Sin embargo, reiteran que la enfermedad podría cursar con una meningoconcefalitis «en una minoría muy pequeña». «Por cada caso conocido de virus del Nilo Occidental, hay 100 que no se conocen», detallaron estas mismas fuentes en el mes de junio.
EL VIRUS DEL NILO, ENDÉMICO EN ESPAÑA
España presenta en la actualidad una situación endémica de la enfermedad debido a que reúne unas condiciones favorables para el mantenimiento y la circulación del virus, como son la gran variedad de posibles reservorios, la proximidad a zonas endémicas como África, las características ecológicas y climáticas, las rutas migratorias de aves procedentes de áreas afectadas y la presencia de vectores competentes ampliamente difundidos por la geografía española.
Todo ello hace que, en la época de riesgo, época de actividad del vector, se puedan dar brotes tanto en animales como en personas en diversas zonas de la península que cuentan con las condiciones idóneas –grandes poblaciones de mosquitos, pequeñas áreas urbanas en entornos agrícolas o naturales y explotaciones de équidos, entre otros–.
El riesgo se considera mayor en las áreas geográficas en las que se ha detectado la presencia del virus, ya sea mediante estudios de investigación independientes o mediante los sistemas de vigilancia animal, humana o entomológica.
Así las cosas, en el año 2020 se detectó un aumento marcado de la incidencia de la enfermedad en España, con 77 casos humanos (56 en Sevilla, 15 en Cádiz y seis en Badajoz). De ellos, el 97 % cursaron con meningoencefalitis y ocho de ellos fallecieron, según se recoge en la segunda parte del informe ‘Plan de vigilancia, prevención y control de las enfermedades transmitidas por vectores’, al que ha tenido acceso Europa Press. En el año 2021 se confirmaron seis casos humanos con meningoencefalitis, todos ellos repartidos en municipios de la provincia de Sevilla.
En 2022 se notificaron cuatro casos humanos autóctonos, de los que 3 casos fueron identificados en dos regiones donde previamente no se habían identificado casos humanos: Tarragona y Córdoba.
En resumen, en España existen zonas de circulación conocida del virus del Nilo Occidental desde hace décadas, como son en Andalucía las marismas del Guadalquivir, en Sevilla, y la comarca de La Janda, en Cádiz, en Extremadura en determinadas áreas lacustres, y en Cataluña en el Delta del Ebro, aunque no se puede descartar la aparición de nuevas detecciones en el resto de la geografía española. Sin embargo, Sanidad considera este riesgo como «inexistente».
CÓMO SE PRODUCE EL CONTAGIO
En las regiones templadas y subtropicales, la mayoría de las infecciones presentan una marcada estacionalidad, desde verano hasta principios de otoño. Los sitios donde se producen los brotes se encuentran a lo largo de las principales rutas de las aves migratorias.
En las zonas endémicas, el virus se mantiene en un ciclo zoonótico entre aves y mosquitos. Las aves actúan como reservorios del VNO, amplificándolo sin padecer la mayoría de las especies la enfermedad clínica, por lo que contribuyen a su mantenimiento y difusión de forma silente.
Las aves migratorias pueden transportar al virus a largas distancias. Los mosquitos hembra infectados pueden transmitir el VNO a través de la picadura tanto a humanos como a équidos, que son las especies de mamíferos más susceptibles a la enfermedad. Se comportan como hospedadores accidentales, puesto que la viremia es corta y de bajo nivel, insuficiente para que el virus se transmita de nuevo a los mosquitos. Es decir, un mosquito que pique a una persona infectada no trasladará la enfermedad.
La transmisión de persona a persona se considera muy poco frecuente y solo puede ocurrir por transfusión de sangre y sus componentes o trasplante de órganos, por vía transplacentaria o por exposición accidental.
06 agosto 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
ago
5
 Más de 175 000 personas mueren cada año en Europa debido a los efectos del calor, según un comunicado publicado el jueves por la división Europa de la Organización Mundial de la Salud (OMS).
Más de 175 000 personas mueren cada año en Europa debido a los efectos del calor, según un comunicado publicado el jueves por la división Europa de la Organización Mundial de la Salud (OMS).
Entre los aproximadamente 489 000 decesos mundiales relacionados con el calor registrados anualmente por la OMS entre 2000 y 2019, «la región europea representa 36 % [de estas víctimas], es decir, un promedio de 176 040 muertes al año» durante este período.
La región Europa de la OMS, que se extiende hasta Asia Central, es la que se está calentando más rápido, a una velocidad aproximadamente el doble de la media global, señala la organización.
En los últimos 20 años la mortalidad relacionada con el calor aumentó 30 % en la región.
«Las temperaturas extremas exacerban las enfermedades crónicas, incluidas las cardiovasculares, respiratorias y cerebrovasculares, la salud mental y las afecciones relacionadas con la diabetes», explica la OMS Europa.
También son responsables del «estrés térmico», que ocurre cuando el cuerpo humano ya no puede mantener su temperatura entre 36 y 37 °C, y que hoy en día es la principal causa de mortalidad relacionada con el clima en la región.
Según la OMS el número de víctimas por calor «se disparará» en los próximos años debido al cambio climático, responsable del aumento de las olas de calor en Europa en las últimas décadas.
«Los tres años más calurosos jamás registrados en la región europea de la OMS se han producido desde 2020, y los diez años más calurosos desde 2007″, detalló el director regional de la organización, Hans Kluge, citado en el comunicado.
El 25 de julio el secretario general de la ONU, Antonio Guterres, hizo un llamado a estar a la altura frente a la «epidemia» de calor extremo y abogó por medidas concretas para enfrentar a este «asesino invisible».
Guterres urgió a atender a las personas vulnerables, proteger a los trabajadores expuestos al calor y limitar el aumento de la temperatura global a 1,5 °C.
02 agosto 2024|Fuente: AFP |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
31
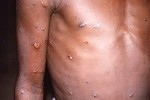 El Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC, por sus siglas en inglés) ha asegurado que el riesgo para la Unión Europea (UE) y el Espacio Económico Europeo (EEE) de que llegue la nueva variante mpox surgida en República Democrática del Congo es «muy bajo».
El Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC, por sus siglas en inglés) ha asegurado que el riesgo para la Unión Europea (UE) y el Espacio Económico Europeo (EEE) de que llegue la nueva variante mpox surgida en República Democrática del Congo es «muy bajo».
Así, el ECDC está trabajando estrechamente con el CDC de África y con socios locales e internacionales para vigilar y responder al empeoramiento del brote de mpox en dicho país.
Aunque el riesgo para la UE y el EEE sigue siendo muy bajo, desde principios de 2024 se han notificado en la RDC más de 11 000 casos sospechosos de mpox, entre ellos unas 450 muertes. A la preocupación por el brote se suma la aparición de una nueva variante del virus mpox de clado I que se cree que causa una enfermedad más grave y una mayor mortalidad que la variante de clado II que circula en todo el mundo desde 2022.
«Me gustaría destacar que el riesgo para la población de la UE y el EEE de la nueva variante de mpox identificada en la RDC sigue siendo muy bajo. El ECDC está colaborando con nuestros socios en África en sus esfuerzos por contener este brote en beneficio de todos los afectados, evitar que esta nueva variante se siga propagando y reforzar las futuras capacidades de preparación y respuesta», afirma la directora del ECDC, Pamela Rendi-Wagner.
A pesar de la preocupación por la nueva variante del clado I, se espera que las vacunas y los tratamientos actuales sigan siendo eficaces. No hay pruebas de que la variante del clado I esté circulando fuera de África central.
Expertos de todo el ECDC han estado trabajando estrechamente con sus socios de Africa CDC para apoyar la respuesta al brote. A través del ‘ECDC and Africa CDC partnership project’, los expertos del ECDC están contribuyendo a una rápida revisión de la literatura para ayudar a identificar las lagunas en el conocimiento de la variante mpox del clado I y orientar la investigación futura. También están apoyando una revisión en acción de la respuesta al brote de mpox en la RDC para informar sobre las actividades de preparación y respuesta.
Además, el ECDC se está preparando para el despliegue en la RDC de un Grupo Operativo Sanitario de la UE (EUHTF), facilitado por la Red Mundial de Alerta y Respuesta ante Brotes Epidémicos (GOARN), como parte de los esfuerzos proactivos más amplios para apoyar la salud mundial y reforzar las defensas de Europa contra las enfermedades infecciosas.
Un epidemiólogo del ECDC se unirá a sus colegas de los CDC africanos y de la Organización Mundial de la Salud (OMS) sobre el terreno en la RDC para contribuir a la respuesta al brote dirigida por el Ministerio de Salud Pública de la RDC. Los esfuerzos del Grupo Operativo de Salud de la UE en la RDC se centrarán en la vigilancia, la investigación sobre el terreno y los proyectos de investigación.
Desde 2022, se han detectado 22 592 casos de mpox en la UE/EEE en un brote no relacionado de la variante menos grave del clado II. Los casos han disminuido constantemente desde su pico en julio de 2022. Nueve países de la UE/EEE notificaron un total de 98 casos en las cuatro semanas transcurridas hasta el 5 de julio de 2024, los datos más recientes disponibles.
En la UE/EEE, el riesgo de infección por mpox clado II sigue siendo bajo para la población general y moderado entre los grupos de mayor riesgo, como las personas que tienen múltiples parejas sexuales y algunos hombres que tienen relaciones sexuales con hombres.
El ECDC sigue apoyando a los Estados miembros de la UE/EEE en la respuesta al brote actual de mpox clade II, publicando orientaciones de salud pública, comunicación de riesgos y recursos de participación comunitaria, así como boletines periódicos de vigilancia conjunta con la Oficina Regional de la OMS para Europa. El ECDC evalúa el riesgo global del brote actual de mpox clade II en Europa como moderado para los hombres que tienen relaciones sexuales con hombres y bajo para la población en general.
29 julio 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jul
27
 Ante el alza de casos de tos ferina a nivel mundial y en algunos países de las Américas, la Organización Panamericana de la Salud (OPS) instó a fortalecer la vigilancia y dar seguimiento constante a las coberturas de vacunación infantil.
Ante el alza de casos de tos ferina a nivel mundial y en algunos países de las Américas, la Organización Panamericana de la Salud (OPS) instó a fortalecer la vigilancia y dar seguimiento constante a las coberturas de vacunación infantil.
Conocida también como coqueluche, esta es una infección respiratoria altamente contagiosa causada por la bacteria Bordetella pertussis que se transmite fácilmente de persona a persona a través de la tos y los estornudos, y es una importante causa de enfermedad y muerte en niños.
Si se trata a tiempo, los antibióticos pueden ayudar a prevenir síntomas graves, explicó en su alerta epidemiológica la OPS.
De acuerdo con los expertos, sus síntomas suelen aparecer de siete a 10 días después de la infección e incluyen fiebre leve, secreción nasal y tos seca seguida de un sonido característico de tos que da nombre a la enfermedad.
Entre 2010 y 2019 en el mundo se reportaron en promedio 170 000 casos de tos ferina cada año, con una disminución significativa observada durante la pandemia de la covid-19, pero últimamente los reportes van en ascenso.
La región de Europa de la Organización Mundial de la Salud, por ejemplo, registró un aumento significativo de casos durante la segunda mitad de 2023 y en los primeros meses de 2024.
Por su parte, en la región de las Américas, desde 2012, cuando los casos de tos ferina alcanzaron los 72 328, los reportes disminuyeron hasta contabilizarse 3 283 en 2022.
Sin embargo, en el año en curso los casos aumentaron en varios países del área, entre ellos, Brasil, México, Perú y Estados Unidos.
Para los especialistas tal incremento probablemente se deba a una disminución significativa en la cobertura de la vacunación contra la difteria, el tétanos y la tos ferina (DTP), principalmente durante el período de la pandemia.
Ante este panorama, la OPS recomienda que los países garanticen una cobertura de vacunación de las tres dosis de DTP superior al 95 % en niños y extenderla también a los trabajadores de la salud, especialmente los que laboran en maternidades, así como a las mujeres embarazadas.
26 julio 2024|Fuente: Prensa Latina |Tomado de |Noticia
jul
27
 Los adultos europeos consumen un promedio de 9,2 litros de alcohol puro al año, lo que los convierte en los mayores bebedores del mundo, comunicó hoy la Organización Mundial de la Salud (OMS).
Los adultos europeos consumen un promedio de 9,2 litros de alcohol puro al año, lo que los convierte en los mayores bebedores del mundo, comunicó hoy la Organización Mundial de la Salud (OMS).
Según un nuevo informe de OMS/Europa, que abarca a los países europeos y centroasiáticos, en el área se mantiene la costumbre de beber alcohol a pesar de los riesgos que implica para la salud.
El estudio abarcó a 53 países y reveló que los hombres de la región beben casi cuatro veces más que las mujeres y que los bebedores suman 470 millones.
Los datos mostraron que dos terceras partes de los adultos beben, uno de cada 10 tiene un trastorno por consumo de alcohol y cerca del seis por ciento vive con dependencia de esta sustancia.
Sin embargo, apenas 12 de los 53 países en cuestión han avanzado en la reducción del consumo en un 10 % desde 2010.
En los países con mayor población de Europa como Rusia, Turquía y Ucrania se han registrado disminuciones notables en el consumo de bebidas alcohólicas debido al aumento de los impuestos y las limitaciones de disponibilidad.
La OMS explicó que esas reducciones hacen parecer en los números totales que hay una baja importante en el consumo de alcohol en Europa como región, aunque en realidad no sea así, pues no se evidencia ningún cambio en la ingestión de bebidas alcohólicas en más de 10 años.
Los expertos alertaron sobre el impacto de largo alcance que supone este hábito, el cual incluye violencia doméstica, accidentes y problemas de salud mental.
El alcohol es el causante de cientos de miles de enfermedades cardiovasculares, lesiones, cánceres y cirrosis hepática en la zona, donde constituye una de las principales causas de muerte: casi 800 000 al año.
Las enfermedades no transmisibles como las cardíacas, el cáncer, la diabetes y los padecimientos respiratorios crónicos, representan el 90 % de los decesos y el 85 % de los años de discapacidad en la región europea de la OMS.
Ante este panorama la agencia de las Naciones Unidas instó a los países a implementar políticas efectivas para reducir el consumo de alcohol.
26 julio 2024|Fuente: Prensa Latina |Tomado de |Noticia

