jul
1
 Gaza está hoy frente al enorme riesgo de propagación de enfermedades transmisibles como diarreas por el agua, la contaminación de los escasos alimentos, la proliferación de mosquitos y golpes de calor, alertó la Organización Mundial de la salud (OMS).
Gaza está hoy frente al enorme riesgo de propagación de enfermedades transmisibles como diarreas por el agua, la contaminación de los escasos alimentos, la proliferación de mosquitos y golpes de calor, alertó la Organización Mundial de la salud (OMS).
Se trata de una combinación muy difícil no tener agua, basura por todos lados y altas temperaturas, algo que puede provocar la aparición de varias enfermedades transmisibles, dijo el portavoz de la OMS, Tarik Jašarević, quien afirmó que se han registrado unos 470 000 casos de diarrea desde el comienzo de la guerra.
Tal situación puede agravarse por la decisión de Israel de impedir a la ONU recoger la basura de los vertederos en Gaza, lo que está provocando condiciones sanitarias extremadamente terribles, que hacen temer una mayor propagación de enfermedades.
Montones de basura que se pudren con el calor se acumulan por toda la Franja entre los desplazados, algo que genera otros temporales, que tampoco pueden limpiar por las limitaciones a la importación y la distribución de combustible, dijo la vocera de la Agencia de las Naciones Unidas para los Refugiados, Louise Wateridge.
«La gente vive entre basura, rodeada de basura. Es una situación muy difícil. Además, la gente construye refugios con plásticos y la temperatura dentro es aún mayor que fuera. Son condiciones realmente insoportables», comentó.
La OMS ha calificado de crítica la situación sanitaria y humanitaria en la Franja de Gaza, a la cual consideró una zona muerta con gran parte del territorio destruido.
También alertó que el calor abrasador en ese territorio podría exacerbar los problemas de salud de los palestinos desplazados, mientras el Programa Mundial de Alimentos advirtió que se avecina una enorme crisis de salud pública en Gaza debido a la falta de agua potable, alimentos y suministros médicos.
La agencia sanitaria de la ONU calculó, además, que más de 10 000 enfermos y heridos necesitan tratamiento fuera de la Franja y pidió que se establezcan corredores médicos urgentemente.
Las autoridades de Gaza han denunciado más de 37 700 muertos, a los que se suman más de 520 palestinos fallecidos en Cisjordania y Jerusalén Este desde el pasado 7 de octubre en operaciones por parte de las fuerzas israelíes o en ataques perpetrados por colonos.
29 junio 2024|Fuente: Prensa Latina |Tomado de |Noticia
jun
20
 Las enfermedades gastrointestinales y respiratorias son las que más aquejan hoy en día a nuestro sistema, explicó la portavoz del Ministerio de Salud y Asistencia Social (Mspas) de Guatemala, Ana Luisa Olmedo.
Las enfermedades gastrointestinales y respiratorias son las que más aquejan hoy en día a nuestro sistema, explicó la portavoz del Ministerio de Salud y Asistencia Social (Mspas) de Guatemala, Ana Luisa Olmedo.
En relación con las primeras, la vocera de la cartera sanitaria detalló que atienden aquellas provocadas por el norovirus, rotavirus y adenovirus, que se caracterizan por diarrea, fiebre, dolor estomacal y deshidratación.
La mayor cantidad de infecciones respiratorias que se presentan son las agudas, especialmente el Virus Sincitial, agregó la funcionaria, citada por el diario local Prensa Libre.
Estas se asocian con la tendencia de las personas a estar en interiores y al hacinamiento que se da cuando tratan de protegerse de la lluvia, acotó.
En la actual temporada aumentan personas con gripe, influenza, bronquitis y neumonía, los cuales se caracterizan por síntomas como fiebre, malestar general, tos, dolor muscular y articular y congestión nasal, subrayó Olmedo.
En el caso de los niños, particularizó, afecta el virus sincitial respiratorio que causa fiebre alta, dolor de cuerpo, pérdida de apetito y decaimiento. Datos del Mspas dan cuenta de la existencia en la semana epidemiológica 22 de influenza A (H3N2), parainfluenza, virus sincitial respiratorio, adenovirus, coronavirus y metapneumovirus.
El médico internista Silvio Eduardo López confirmó al medio de prensa que las enfermedades más recurrentes, debido a las variaciones de clima, son las gastrointestinales.
Recomendó mantener una adecuada hidratación, evitar realizar actividades al aire libre, lavarse en forma correcta las manos, pero también las frutas y verduras que se consumen.
«Es importante evitar consumir alimentos en lugares donde no tengan medidas de higiene y mantenerse abrigado», enfatizó el galeno.
Ante el alza de las precipitaciones en el país, el Mspas declaró la víspera Alerta Naranja Institucional en la red de servicios de salud.
Tal condición puede cambiar –precisó- de conformidad con las condiciones, tanto a nivel nacional como para las regiones en donde el pronóstico de lluvias fue catalogado por encima de lo normal.
El organismo llamó a hervir el agua antes de consumirla, evitar el contacto con las estancadas, no nadar ni bañarse en ríos, charcas o estanques que puedan estar contaminados con residuos fecales o químicos.
Ante la necesidad de guardar el vital líquido, tapar los recipientes y deshacerse de los que puedan acumularlo, para impedir la proliferación de zancudos del dengue.
El Mspas instruyó a las Direcciones Departamentales de Redes Integradas de Servicios de Salud y Direcciones de Hospitales a tomar un grupo de medidas prioritarias.
La época de precipitaciones comenzó en Guatemala concretamente a inicios de este mes y las autoridades esperan registros históricos.
18 junio 2024|Fuente: Prensa Latina |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
15
 El sobrecrecimiento bacteriano en el intestino (SIBO) se ha convertido en un tema de gran interés tanto para los médicos especialistas en aparato digestivo como para la sociedad y esto ha llevado a una situación de sobrediagnóstico, resultando así en diagnósticos incorrectos e ineficaces frente al tratamiento ofrecido, según el experto de la Sociedad Española de Patología Digestiva (SEPD) y jefe del Servicio de Aparato Digestivo del Hospital Universitario de La Princesa (Madrid), el doctor Cecilio Santander.
El sobrecrecimiento bacteriano en el intestino (SIBO) se ha convertido en un tema de gran interés tanto para los médicos especialistas en aparato digestivo como para la sociedad y esto ha llevado a una situación de sobrediagnóstico, resultando así en diagnósticos incorrectos e ineficaces frente al tratamiento ofrecido, según el experto de la Sociedad Española de Patología Digestiva (SEPD) y jefe del Servicio de Aparato Digestivo del Hospital Universitario de La Princesa (Madrid), el doctor Cecilio Santander.
En este sentido, el doctor Santander incide en que es necesario precisar los criterios diagnósticos ya que «su reciente modificación ha llevado a un problema de sobrediagnóstico». El diagnóstico del SIBO requiere una indicación adecuada del test a utilizar y, sobre todo, «que esos resultados sean evaluados por personal formado y experto en la interpretación de los tests funcionales digestivos» porque si no, «se hace un uso generalizado de estas pruebas» que, «sin estrategias de diagnóstico previas llevarán a un tratamiento ineficaz».
Por otro lado, «teniendo en cuenta que hasta un 20 por ciento de personas sanas puede resultar positivas en los tests indirectos de SIBO», declara, añadiendo que «hay que elegir cuidadosamente la prueba diagnóstica para emplearla en pacientes bien seleccionados». A este respecto, cabe destacar que los pacientes con factores de riesgo para desarrollar SIBO son aquellos que han sido sometidos a cirugías intestinales o que padecen alguna enfermedad que altera la motilidad intestinal.
Según explica el experto, las pruebas diagnósticas de SIBO «exigen una preparación muy meticulosa o estricta para que los resultados sean precisos», en relación a esto, la prueba de referencia es el cultivo de aspirado yeyunal, sin embargo, «es una prueba invasiva y costosa», por lo que, de forma alternativa, se emplean métodos indirectos, como es el test de aire espirado (TAE) que «presenta una especificidad más baja, en torno al 83 por ciento». Además, se recomienda utilizar como sustrato del TAE la glucosa por encima de la lactulosa dada su mayor especificidad y sensibilidad.
SIBO: QUÉ ES, SÍNTOMAS Y TRATAMIENTOS
El sobrecrecimiento bacteriano intestinal (SIBO) se define como la presencia de un excesivo número de bacterias en el intestino delgado (ID), que produce un conjunto de síntomas gastrointestinales inespecíficos, como distensión, dolor abdominal, meteorismo, borborigmos, flatulencia, diarrea o estreñimiento, que suelen ser producto de la fermentación bacteriana de los nutrientes.
No obstante, es importante señalar que «los síntomas del SIBO se comparten con un elevado número de otras enfermedades digestivas» sobre todo enfermedades funcionales digestivas, como el Síndrome del Intestino Irritable (SII) o la dispepsia funcional o la Enfermedad Inflamatoria Intestinal (EII). Por eso, «sin un correcto diagnóstico los síntomas pueden no estar provocados por el SIBO y recidivarán a pesar del tratamiento pautado», apunta el doctor Cecilio Santander.
El SIBO es consecuencia de una causa subyacente y «esa es la verdadera estrategia diagnóstica» porque si no se identifica esa causa «no se puede revertir o mejorar el SIBO». Por esto, el experto indica que el tratamiento «debe centrarse en mejorar el síndrome clínico y no limitarse a negativizar el test de aire espirado», así como tampoco debe hacerse uso de antibióticos de forma sistemática en pacientes con patologías funcionales muy prevalentes como el Síndrome del Intestino Irritable (SII).
Es importante que el tratamiento mejore los síntomas del paciente y para ello, no solo es necesario un correcto diagnóstico en los pacientes adecuados, sino, además, contar con profesionales con experiencia en la especialidad ya que «un diagnóstico inadecuado de SIBO conduce a un tratamiento ineficaz que retrasará la identificación de la patología que ocasiona los síntomas del paciente», concluye el doctor Santander.
13 junio 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
10
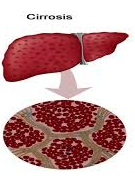 Un equipo de investigadores liderado por el Servicio de Patología Digestiva del Hospital de Sant Pau de Barcelona ha demostrado que una combinación de ejercicio en casa y consumo de aminoácidos y de probióticos mejora significativamente la fragilidad en pacientes con cirrosis.
Un equipo de investigadores liderado por el Servicio de Patología Digestiva del Hospital de Sant Pau de Barcelona ha demostrado que una combinación de ejercicio en casa y consumo de aminoácidos y de probióticos mejora significativamente la fragilidad en pacientes con cirrosis.
En un comunicado, el Hospital de Sant Pau ha informado este jueves de que, a largo plazo, estas intervenciones no farmacológicas mejoran la fragilidad y reducen la incidencia de recaídas y visitas a urgencias en pacientes que presentan la enfermedad hepática.
El estudio, publicado en la revista Hepatology Communications, abre una puerta hacia nuevas estrategias de tratamiento que pueden ser adoptadas ampliamente para beneficiar a más pacientes que se enfrentan a esta compleja enfermedad, según el hospital.
La cirrosis es una condición médica en la que el hígado está cicatrizado y permanentemente dañado que puede ser causada por varios tipos de enfermedades y afecciones hepáticas, como la hepatitis o el alcoholismo crónico.
Cada vez que se da una lesión en el hígado, este intenta recuperarse por sí mismo y, durante el proceso de recuperación, se crea tejido cicatricial.
A medida que la cirrosis empeora, se forma cada vez más tejido cicatricial, lo cual dificulta que el hígado cumpla con su función.
Por lo general, el daño hepático causado por la cirrosis no se puede revertir y una cirrosis en etapa avanzada es mortal.
El Hospital de Sant Pau ha señalado que la fragilidad en pacientes con cirrosis ha sido identificada como un factor primordial que predice hospitalizaciones, recaídas y mortalidad, más allá del grado de insuficiencia hepática.
Sin embargo, con un diagnóstico temprano y si se trata la causa subyacente, es posible limitar el daño adicional.
En este contexto, los investigadores han buscado determinar si una intervención no farmacológica a largo plazo que incluya ejercicio en casa, suplementos de aminoácidos de cadena ramificada (un grupo de aminoácidos frecuentemente usados como suplementos dietéticos) y probióticos podría marcar una diferencia en la vida de los pacientes con cirrosis.
El estudio incluyó a 32 pacientes ambulatorios con cirrosis, clasificados como frágiles o prefrágiles según el Índice de Fragilidad Hepática -un método de evaluación de los pacientes según el riesgo de hospitalización- que fueron divididos aleatoriamente en dos grupos: uno de intervención, que recibió un programa de ejercicio en casa, suplementos de aminoácidos de cadena ramificada y un probiótico multiespecies durante 12 meses; y un grupo de control que recibió la atención estándar.
Los resultados obtenidos muestran una notable mejora en la fragilidad de los pacientes del grupo de intervención, con una significativa disminución en sus puntuaciones del Índice de Fragilidad Hepática a lo largo del año, por tanto, se redujo el riesgo de hospitalización de los pacientes con cirrosis hepática.
Los investigadores han subrayado la importancia de un «enfoque holístico» en el tratamiento de la cirrosis, destacando cómo intervenciones simples y accesibles pueden tener un impacto profundo en los resultados de salud y la calidad de vida.
Por esta razón, el Hospital de Sant Pau ha puesto en marcha esta semana un programa de ejercicio en casa con el objetivo de enseñar a los pacientes de cirrosis cómo llevar a cabo estos ejercicios mediante una app para mejorar su pronóstico y su calidad de vida.
El estudio ha estado liderado por el Servicio de Patología Digestiva en colaboración con los Servicios de Medicina Física y Rehabilitación, Farmacia y Bioquímica, el Instituto de Investigación y la Escuela Universitaria de Enfermería de Sant Pau y el CIBERehd.
06 junio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
jun
7
 La población de Gaza vive hoy una emergencia sanitaria sin comparación: lesiones, traumas, trastornos mentales y enfermedades infecciosas que se propagan por la falta de servicios básicos y la destrucción de los hospitales.
La población de Gaza vive hoy una emergencia sanitaria sin comparación: lesiones, traumas, trastornos mentales y enfermedades infecciosas que se propagan por la falta de servicios básicos y la destrucción de los hospitales.
Además, los padecimientos crónicos no reciben atención y la desnutrición avanza a un ritmo acelerado, de acuerdo con vivencias e informes de la Agencia de la ONU para los Refugiados Palestinos (Unrwa) y la Organización Mundial de la Salud (OMS).
En los ya casi ocho meses de agresión israelí a la Franja de Gaza, la población sufre gravemente por la falta de servicios de salud de todo tipo y las enfermedades aumentan aceleradamente, de acuerdo con el Informe Anual de Salud, donde la Unrwa advirtió que los gazatíes padecen todo tipo de lesiones como consecuencia de la guerra.
Tales afectaciones sanitarias se suman a las enfermedades infecciosas que se propagan fácilmente dadas las condiciones de vida infligidas por los bombardeos, ataques terrestres y desplazamientos masivos de población que dan lugar a hacinamiento, falta de agua y nulas condiciones de higiene.
La destrucción de la infraestructura y el transporte han complicado aún más la prestación de atención sanitaria para estos males, al igual que para las enfermedades crónicas, a lo se sumaron los obstáculos y prohibiciones de dar paso de la asistencia humanitaria internacional.
El informe expone el aumento de casos de hepatitis aguda y diversas formas de diarrea, en tanto un tercio de los niños de Gaza padecen desnutrición aguda.
Alarmante es también que la atención médica en Gaza disminuyó a partir del 7 de octubre último, y sólo en el último trimestre del pasado año dejaron de funcionar 14 de 22 centros de salud debido a los ataques, destrucción o asedios.
Unrwa explicó que como respuesta abrió 155 refugios de emergencia y desplegó 108 unidades médicas móviles, coordinó el envío de medicamentos esenciales e implementó vigilancia de brotes de enfermedades.
El director de Salud de esa agencia, Akihiro Seita indicó que el personal del organismo permaneció en primera línea y recordó que hasta mayo de este año, había perdido más de 191 trabajadores, incluidos 11 profesionales de la salud.
Actualmente más de dos millones de pacientes dependen de sus servicios sanitarios en cinco campos de operaciones: Gaza, Cisjordania -incluida Jerusalén oriental-, Jordania, Líbano y Siria.
Por su parte, la OMS mantiene a su personal asistiendo a los gazatíes, acciones que llevan a cabo 18 equipos sanitarios que han ofrecido unas 400 000 consultas, realizado más de 18 000 cirugías y añadido más de 500 camas hospitalarias en la Franja de Gaza en todos los niveles de atención.
Tanto en el norte como en el sur de la Franja esos servicios y capacidades proporcionan, aunque de forma muy limitada, estabilización de traumatismos, partos, apoyo a la alerta temprana de brotes de enfermedades y otras urgencias.
Junto con sus socios en el terreno, la OMS también ha apoyado los traslados de pacientes y entregado alimentos, agua y suministros médicos a centros de salud.
Como afirmara su director general, Tedros Adhanom Ghebreyesus, la agencia sanitaria de la ONU estaba en Gaza antes del inicio del conflicto y seguirá ahí para apoyar al sistema de salud hasta que termine, y ayudar a su reconstrucción.
La pasada semana el titular de la OMS insistió en un alto el fuego urgente en la Franja de Gaza y alertó sobre la crisis humanitaria en ese territorio.
«La destrucción de carreteras, la falta de acceso seguro y de combustible para las misiones siguen impidiendo el movimiento hacia el norte. La ciudad está llena de escombros y desechos sólidos», denunció.
En varias ocasiones tanto la OMS como su director general y otros altos funcionarios criticaron las operaciones militares israelíes por las graves consecuencias para la población gazatí, en especial los ataques contra hospitales y campamentos de refugiados.
Según la organización, en los primeros siete meses de conflicto en Gaza, el Ejército de Israel ejecutó 443 ataques contra sus efectivos sanitarios.
Hoy la agresión de Israel contra la Franja de Gaza suma más de 36 mil 500 vidas, en su mayoría mujeres y niños, y ha dejado a toda la población sin medios de subsistencia en una situación nunca antes sufrida en el enclave palestino, con toda su sociedad al borde del colapso.
04 junio 2024|Fuente: Prensa Latina |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
may
2
 La Asociación Española para el Estudio del Hígado (AEEH) ha dado a conocer este martes el Plan Nacional de Salud Hepática: Reto 2032, que ha presentado recientemente al Ministerio de Sanidad, con el fin de impulsar la prevención y el diagnóstico precoz de la enfermedad hepática, cuya incidencia está en aumento en España.
La Asociación Española para el Estudio del Hígado (AEEH) ha dado a conocer este martes el Plan Nacional de Salud Hepática: Reto 2032, que ha presentado recientemente al Ministerio de Sanidad, con el fin de impulsar la prevención y el diagnóstico precoz de la enfermedad hepática, cuya incidencia está en aumento en España.
«La situación en España es un incremento de la morbilidad y de la mortalidad asociada a la enfermedad hepática, mientras que, en otras enfermedades, está descendiendo, como es el caso de la mortalidad por cáncer o enfermedad cardiovascular», ha advertido el doctor Manuel Romero, jefe de Sección de Aparato Digestivo en el Hospital Universitario Virgen del Rocío de Sevilla, en un encuentro informativo celebrado este martes y organizado por Europa Press.
De hecho, uno de cada cinco españoles se encuentra en riesgo de padecer una enfermedad del hígado y las patologías relacionadas con este órgano representan ya la tercera causa de muerte prematura en España. Este ascenso en la incidencia se relaciona con el incremento de los hábitos y estilos de vida poco saludables, como son el abuso en el consumo de alcohol, una dieta poco saludable y el sedentarismo, entre otros.
A los especialistas les preocupa en especial la creciente prevalencia tanto de la enfermedad conocida como hígado graso (esteatosis hepática metabólica), ligada a la obesidad y la diabetes tipo 2, como la de la enfermedad hepática relacionada con el consumo de alcohol.
La primera es ya la patología hepática más prevalente en España, pues se estima que afecta a tres de cada diez españoles, y ambas han desplazado ya a las hepatitis virales como principal causa de cirrosis, cáncer de hígado e indicación de trasplante, con la particularidad además de que la incidencia de estas dos patologías no solo está avanzando, sino que lo hace a edades cada vez más tempranas. De hecho, en la última década se han triplicado los casos de cáncer de hígado por hígado graso.
MÁS DE 50 LÍNEAS DE ACTUACIÓN
En total, y para mejorar el abordaje de todas estas afecciones hepáticas, el Plan identifica un total de quince objetivos estratégicos y más de 50 líneas de acción, clasificados en tres grandes áreas de actuación: prevención, diagnóstico, tratamiento y seguimiento. Las medidas están ordenadas por orden de importancia.
Por su parte, el doctor José Luis Calleja, jefe adjunto del Servicio de Gastroenterología del Hospital Universitario Puerta de Hierro Majadahonda (Madrid) y presidente de la AEEH, ha detallado que el documento tiene como objetivo «intentar influir en los políticos sobre la importancia de invertir en salud», como ya hiciera en 2015 el Plan Nacional de Hepatitis C. «Este Plan, en cuatro años, consiguió curar a más de 260 000 personas de hepatitis C. Se han reducido las personas que necesitan un trasplante del 49 al 12 % en 2022. Hemos demostrado que, en hígado, invertir supone ahorrar», ha rememorado.
El Plan pone por ello el foco en la prevención y en la detección precoz. «La dieta y el ejercicio es prevención y tratamiento, teniendo en cuenta que no hay ningún tratamiento farmacológico para el hígado graso», ha explicado por su parte la doctora Rocío Aller, especialista en Aparato Digestivo del Hospital Clínico de Valladolid, y secretaria de la AEEH. Tal y como ha especificado, el tratamiento «se basa en la dieta mediterránea», si bien esta tiene que ser personalizada y acompañarse de las nuevas tecnologías, como el uso de la inteligencia artificial.
Además, el Plan considera imprescindible abordar el consumo de alcohol a edades cada vez más tempranas, pues es ya la primera causa de desarrollo de cirrosis y de necesidad de trasplante hepático, además de que está detrás de más del 50 por ciento de los cánceres de hígado.
Igualmente, estima imprescindible intervenciones decididas en prevención de la obesidad, que está detrás de la progresión del hígado graso, que afecta ya a más de 10 millones de españoles, de los que cerca de dos millones presentarían inflamación del hígado (esteatohepatitis) y, de ellos, 400 000 presentarían ya una cirrosis hepática.
ENFERMEDADES SILENTES
En relación con la detección precoz, la gran dificultad es que las afecciones del hígado son enfermedades silentes, según los expertos, pues sus síntomas son inespecíficos y no se manifiestan hasta que el hígado presenta un daño elevado. Sin embargo, su diagnóstico temprano es fundamental para cambiar el pronóstico de la enfermedad. Así, por ejemplo, el cambio en la dieta y la actividad física permite revertir la enfermedad en más del 80 por ciento de los casos.
Por todo ello, el Plan incide en la necesidad de hacer un cribado de enfermedad hepática en todas las personas que presentan factores de riesgo como diabetes, obesidad o abuso en el consumo de alcohol. Además, más del 90 % de los casos de cáncer hepático aparece en personas con enfermedad hepática crónica, «lo que podría permitir el diagnóstico precoz de esta enfermedad», según Aller.
Más allá del hígado graso y de las enfermedades hepáticas asociadas al consumo de alcohol, el Plan también incluye las hepatitis virales, a las que considera «un desafío no resuelto». Así, el doctor Javier Crespo, jefe del servicio de Aparato Digestivo del Hospital Universitario Marqués de Valdecilla, ha llamado a la equidad en la vacunación de la hepatitis A y B. «A pesar de que hemos avanzado mucho en los tratamientos en España, uno de cada cuatro pacientes que tratamos de hepatitis viral tiene enfermedad hepática avanzada», ha explicado.
Durante el encuentro, también ha estado presente la presidenta de la Federación Nacional de Trasplantados Hepáticos, Eva Pérez Bech, quien ha lamentado el estigma que rodea a las enfermedades hepáticas. «Parece que los pacientes se lo han buscado por sus hábitos de vida. Los pacientes hepáticos sufren mucho y en silencio porque no se atreven a decirlo», ha comentado.
Finalmente, el Plan también se ocupa de las enfermedades hepáticas minoritarias (clasificadas en tres grupos: autoinmunes, tóxico-metabólicas y vasculares-hepáticas), incidiendo en la importancia que debe tener la medicina de precisión para una mejor caracterización de las mismas y posibilitar así una mejor atención y práctica clínica con los pacientes. También se insiste en la necesidad de invertir en investigación en este ámbito.
«El Plan nace con vocación de aunar la experiencia que hemos desarrollado en la hepatología de los últimos 50 años. De aquí al 2032, los decisores políticos deben ser capaces de dar luz al Plan y conseguir normas y leyes que regulen tanto los aspectos beneficiosos como negativos, porque esa será la base para conseguir que en 2032 no tengamos hepatitis C de ningún tipo», ha finalizado.
30 abril 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia

