mar
21
 Los usuarios de cigarrillos electrónicos con un historial limitado de tabaquismo experimentan cambios en el ADN de las células del interior de las mejillas similares a los de los fumadores y que se asocian, en ese segundo grupo, al desarrollo futuro de cáncer del pulmón. Un estudio que publicado Cancer Reseach analizó en más de 3.500 muestras los efectos epigenéticos del tabaco y los cigarrillos electrónicos en la metilación del ADN, un mecanismo epigenético fundamental en la regulación de la expresión de los genes y de cómo funcionan.
Los usuarios de cigarrillos electrónicos con un historial limitado de tabaquismo experimentan cambios en el ADN de las células del interior de las mejillas similares a los de los fumadores y que se asocian, en ese segundo grupo, al desarrollo futuro de cáncer del pulmón. Un estudio que publicado Cancer Reseach analizó en más de 3.500 muestras los efectos epigenéticos del tabaco y los cigarrillos electrónicos en la metilación del ADN, un mecanismo epigenético fundamental en la regulación de la expresión de los genes y de cómo funcionan.
El objetivo era investigar el impacto en las células que están expuestas directamente al tabaco (por ejemplo, en la boca) y las que no lo están (en la sangre o el cuello uterino). ‘No podemos afirmar que los cigarrillos electrónicos provoquen cáncer basándonos en nuestro estudio, pero sí observamos’ que sus consumidores ‘presentan algunos cambios epigenéticos en las células bucales similares a los de los fumadores, y estos cambios están asociados al desarrollo futuro de cáncer de pulmón en los fumadores’.
Así lo indicó Chiara Herzog, del University College de Londres y de la Universidad de Innsbruck (Austria), una de las firmantes de la investigación. Herzog agregó que serán necesarios más estudios para investigar si estas características podrían utilizarse para predecir individualmente el cáncer en fumadores y usuarios de cigarrillos electrónicos.
El epigenoma se refiere a una capa extra de información que se superpone a nuestro material genético, el ADN. Este se puede comparar con el ‘hardware’ de un ordenador, mientras que la epigenética sería como ‘’software’, que define cómo, dónde y cuándo se ejecutan los programas que éste utiliza, explica el Univesity College en un comunicado.
Los epigenomas cambian a lo largo de nuestra vida y pueden verse afectados por diversos factores genéticos o no genéticos, como el envejecimiento, el estilo de vida, la exposición a hormonas, sustancias químicas y factores ambientales, e incluso el estrés y los traumas psicológicos.
Los investigadores descubrieron que las células epiteliales de la boca mostraban cambios epigenómicos sustanciales en los fumadores, que son aún más elevados en los cánceres o precánceres de pulmón, en comparación con el tejido pulmonar normal, lo que apoya la idea de que los cambios epigenéticos asociados al tabaquismo permiten a las células crecer más rápidamente.
El estudio incluye nuevos datos que muestran que se observaron cambios epigenómicos similares en las células de consumidores de cigarrillos electrónicos que solo habían fumado menos de 100 cigarrillos de tabaco en su vida.
Aunque el consenso científico es que los cigarrillos electrónicos son más seguros que fumar tabaco, no podemos dar por sentado que su uso sea completamente seguro y es importante estudiar sus posibles riesgos a largo plazo y su relación con el cáncer’, dijo Herzog.
Mediante el análisis computacional de las muestras, los investigadores también descubrieron que algunos cambios epigenéticos relacionados con el tabaquismo permanecen más estables que otros tras dejar de fumar, incluidos los relacionados con el tabaquismo en muestras cervicales, algo que no se había estudiado anteriormente.
El epigenoma permite mirar hacia atrás para ver cómo respondió nuestro cuerpo a una exposición ambiental previa, como el tabaquismo, pero también puede permitir predecir la salud y la enfermedad en el futuro, dijo Matin Widschwendter, también firmante del estudio.
Los cambios que se observan en el tejido del cáncer de pulmón también pueden medirse en las células de las mejillas de fumadores que no han desarrollado un cáncer. Y lo que es más importante -destacó- esta investigación apunta a que ‘los usuarios de cigarrillos electrónicos presentan los mismos cambios, por lo que estos dispositivos podrían no ser tan inocuos como se pensaba en un principio.
Ver artículo: Herzog C, Jones A, Evans I, Raut JR, Zikan M, Cibula D, et al. Cigarette smoking and e-cigarette use induce shared DNA methylation changes linked to carcinogenesis. Cancer Res[Internet].2024[citado 21 mar 2024]. https://doi.org/10.1158/0008-5472.CAN-23-2957
20 marzo 2024|Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
mar
21
 Según un estudio de Mayo Clinic publicado por la Nature Neuroscience, las células que actúan en la primera línea de defensa del sistema nervioso central contra las lesiones también juegan un papel en ayudar al cerebro a despertar de la anestesia. Este descubrimiento puede ayudar a allanar el camino para métodos innovadores que abordan las complicaciones post-anestesia.
Según un estudio de Mayo Clinic publicado por la Nature Neuroscience, las células que actúan en la primera línea de defensa del sistema nervioso central contra las lesiones también juegan un papel en ayudar al cerebro a despertar de la anestesia. Este descubrimiento puede ayudar a allanar el camino para métodos innovadores que abordan las complicaciones post-anestesia.
Al salir de la anestesia, más de un tercio de los pacientes puede experimentar somnolencia extrema o hiperactividad, un efecto secundario llamado delirium. Investigadores de Mayo Clinic descubrieron que las células inmunes especiales en el cerebro llamadas microglías pueden proteger a las neuronas de los efectos secundarios de la anestesia para despertar el cerebro.
«Esta es la primera vez que hemos visto que las microglías mejoran e incrementan la actividad neuronal al involucrar físicamente los circuitos cerebrales», dice el neurocientífico de Mayo Clinic, el Ph.D. Long-Jun, autor principal del estudio.
Los investigadores observaron la presencia de microglías entre las neuronas y las sinapsis inhibitorias, suprimiendo la actividad neuronal bajo anestesia. Las microglías parecen tratar de proteger las neuronas para contrarrestar la sedación.
El cerebro está formado por una red de neuronas que dispara y estimula actividades en todo el cuerpo. Las neuronas están conectadas por sinapsis que reciben y transmiten señales que nos permiten movernos, pensar, sentir y comunicarnos. En este entorno, las microglías ayudan a mantener el cerebro sano, estable y en funcionamiento. Aunque las microglías fueron descubiertas hace más de 100 años, solo en los últimos 20 años se han convertido en un foco importante de investigación.
Al principio, los científicos solo tenían láminas fijas de microglías para examinar, lo que les proporcionaba solo imágenes instantáneas de estas células. Inicialmente, se pensó que cuando las neuronas no estaban activas y el cerebro estaba tranquilo, las microglías eran menos activas. Luego, la tecnología hizo posible observar y estudiar las microglías en detalle, incluso la manera en que se mueven.
«Las microglías son células cerebrales únicas porque tienen procesos muy dinámicos. Se mueven y bailan mientras escanean el cerebro. Ahora tenemos imágenes poderosas que muestran sus actividades y movimientos», dice el Dr. Wu.
Hace unos años, el Dr. Wu y su equipo han liderado investigaciones sobre cómo las microglías y las neuronas se comunican entre sí en cerebros sanos y no saludables. Por ejemplo, mostraron que las microglías pueden atenuar la hiperactividad neuronal durante convulsiones epilépticas . Los investigadores pueden observar estas células en el cerebro en tiempo real y registrar sus movimientos en modelos de ratones despiertos utilizando una tecnología de imagen avanzada que incluye una microscopia electrónica de barrido.
En 2019, investigadores descubrieron que las microglías pueden sentir cuando el cerebro y sus actividades están restringidos, por ejemplo, por la anestesia. Descubrieron que las microglías se vuelven más activas y vigilantes cuando esto ocurre.
«Ahora podemos ver que las microglías aumentan su vigilancia y patrullan la actividad neuronal del cerebro como un oficial de policía por la noche, respondiendo a actividades sospechosas cuando todo está tranquilo», dice el Dr. Wu.
Pacientes con delirium o agitación, cuando salen de la anestesia, pueden también sentirse hiperactivos o sentir una lentitud extrema. Los investigadores creen que la hiperactividad puede ser el resultado de la intervención excesiva de las microglías entre las neuronas y las sinapsis inhibitorias.
«Si podemos explorar el papel de las microglías en varios estados fisiológicos como el sueño, podríamos aplicar este conocimiento para mejorar la atención al paciente en entornos clínicos», explica el Ph.D. Koichiro Haruvaka, autor principal del estudio e investigador principal de Mayo Clinic.
Ver artículo: Haruwaka K, Ying Y, Liang Y, Umpierre AD, Min Yi M, Kremen V, et al. Microglia enhance post-anesthesia neuronal activity by shielding inhibitory synapses. Nature Neuroscience[Internet].2024[citado 20 mar 2024]; 27: 449-461. https://doi.org/10.1038/s41593-023-01537-8
20 marzo 2024| Fuente: EurekAlert| Tomado de| Comunicado de prensa
feb
9
 Una mutación genética dota a las células inmunitarias de más poder antitumoral: “No hemos visto ningún tipo de cáncer para el cual no haya funcionado”, afirman sus descubridores.
Una mutación genética dota a las células inmunitarias de más poder antitumoral: “No hemos visto ningún tipo de cáncer para el cual no haya funcionado”, afirman sus descubridores.
Por qué la terapia celular adoptiva, la estrategia en la que se basan las famosas células CAR-T, ¿no acaba de cosechar resultados tan espectaculares en los tumores sólidos como en el cáncer hematológico? Una clave genética para reforzar la potencia de los linfocitos T hallada por unos científicos estadounidenses podría revertir esa situación.
Así lo explica uno de los autores principales de esta investigación que se publica hoy en Nature, Jaehyuk Choi, profesor asociado de Dermatología y Bioquímica y Genética molecular en la Facultad de Medicina Feinberg de la Universidad Northwestern, de Chicago: “Muchas inmunoterapias celulares no funcionan para los tumores sólidos, porque no pueden superar el microambiente del tumor sólido. Existen metabolitos y citocinas y células inmunosupresoras que limitan la persistencia [de los linfocitos T]. Hemos encontrado una forma para aumentar la potencia que ha funcionado en todos los modelos que hemos probado. Aumenta drásticamente la capacidad de las terapias adoptivas con células T para persistir, prosperar y eliminar células tumorales en modelos de ratón de leucemia de células B, cáncer gástrico, cáncer de piel y mesotelioma, un tipo de cáncer de pulmón”.
Un «poder» tumoral que puede usarse contra el cáncer
Para encontrar cómo infundir más potencia a las células, los científicos recurrieron a la propia naturaleza: observaron qué hacía que las células tumorales fueran más fuertes, con la idea de utilizarlo como arma terapéutica.
Así, el equipo de la Universidad Northwestern en estrecha colaboración con el grupo de Kole Roybal, de la Universidad de California en San Francisco (UCSF), con la participación de los investigadores Julie García y Jay Daniels, examinó a pacientes con linfoma de células T, un tipo de cáncer originado a partir de los linfocitos T que en un inicio puede manifestarse con lesiones cutáneas.
Buscaban “el superpoder”, en palabras de Jaehyuk Choi, por el que estas células cancerosas se hacen fuertes. A menudo las células tumorales son capaces de crear un nicho, un entorno que las mantiene con aporte de oxígeno y nutrientes; la hipótesis del estudio era identificar a aquellas más capaces de generar esa fortaleza para poder transferirla a las terapias que usan células T.
Cien veces más potentes
Tras examinar 71 mutaciones encontradas en pacientes con linfoma de células T, finalmente, en modelo de ratón, los científicos aislaron una con capacidad para multiplicar la resistencia sin generar toxicidad. Insertaron el gen que codifica esa única mutación en linfocitos T humanos normales lo que los hizo 100 veces más potentes para matar células tumorales sin ningún signo de que fueran a volverse tóxicos.
“Descubrimos la mutación originalmente en una célula T CD4+. En un sorprendente giro de los acontecimientos, esta mutación, cuando se expresa en una célula T CD8+, le confiere capacidades especiales, en particular la capacidad de crear células T CD8+ con capacidades únicas; en este caso, las hacen capaces de efectuar cosas que normalmente solo pueden hacer las células T CD4+, como producir altos niveles de interleucina 2 (IL-2). Esa capacidad fortalece a los linfocitos y les otorga capacidades únicas para persistir sin la ayuda de las células T CD4+ en los tumores”, explica a este medio en un email Jaehyuk Choi.
Este super linfocito T diseñado por la Northwestern y la UCSF logró acabar, en modelo experimental, con tumores de piel, de pulmón y de estómago.
El equipo ya ha comenzado a trabajar para probar la nueva estrategia en pacientes. “Estamos entusiasmados por intentar llevar estas tecnologías a la clínica. En colaboración con el coautor Kole Roybal (UCSF) hemos puesto en marcha una empresa cuya misión expresa es hacer precisamente eso”, comenta el científico.
Mientras el manuscrito de este estudio estaba en imprenta, la agencia reguladora estadounidense FDA anunció la investigación de unos pocos casos de pacientes que habían recibido alguna de las terapias CAR-T frente a CD19 o BCMA aprobadas y que con el tiempo desarrollaron un linfoma de célula T.
Un caso de mil
La agencia identifica a 22 pacientes, entre las casi 30.000 de que han recibido la terapia avanzada en todo el mundo. Finalmente, la FDA ha pedido a los fabricantes de las seis terapias con CAR-T comerciales autorizadas en Estados Unidos que incluyan en sus envases un recuadro de advertencia sobre el riesgo potencial de generar, de forma secundaria, neoplasias malignas de células T
Los autores del estudio de Nature escriben al respecto que “nuestros estudios singénicos y de xenoinjerto in vivo a largo plazo, realizados en múltiples modelos y con altas dosis de células T, no mostraron signos de linfomagénesis, incluso 418 días después de la transferencia adoptiva de células T”. También recuerdan en el artículo que los pacientes con neoplasias malignas de células B (incluso sin tratamiento con CAR-T) tienen un mayor riesgo específicamente de padecer linfomas de célula T. Sobre esta cuestión Jaehyuk Choi afirma que “es difícil hacer comentarios, pues no sabemos los suficiente sobre estas neoplasias malignas” y opina que “nuestro trabajo muestra que desarrollar cáncer de células T puede ser más difícil de lo pensado originalmente”.
Ver artículo completo: Garcia J, Danels J, Lee Y, Zhu L, Cheng K, Liu Q, et al. Naturally occurring T cell mutations enhance engineered T cell therapies. Nature [Internet].2024[citado 8 feb 2024]. https://www.nature.com/articles/s41586-024-07018-7
7 de febrero 2024|Fuente: Diario Médico| Tomado de | Medicina| Inmunología
ene
4
 Un equipo de investigadores de la Universidad de Lausana (Suiza) rastreó el origen de una enigmática población de células TCM de memoria central (TCM, por sus siglas en inglés), que posee propiedades que confieren memoria inmunológica en un modelo animal, resolviendo así un largo debate científico de 18 años.
Un equipo de investigadores de la Universidad de Lausana (Suiza) rastreó el origen de una enigmática población de células TCM de memoria central (TCM, por sus siglas en inglés), que posee propiedades que confieren memoria inmunológica en un modelo animal, resolviendo así un largo debate científico de 18 años.
Estas células TCM, similares a células madre, son fundamentales para la capacidad del sistema inmunológico adaptativo (no innato) de crear recuerdos inmunológicos duraderos. Esta capacidad es crítica para controlar los patógenos en episodios de infección o reexposición, y para desencadenar una rápida movilización de la defensa vital del hospedero.
Aunque son esenciales para la respuesta inmune general, desde su descubrimiento en 2005 estas TCM han estado profundamente envueltas en debates y controversia sobre quiénes son sus precursoras.
El equipo del estudio, que fue publicado recientemente en Science Immunology, constató que las TCM emergieron rápidamente al exponer a los animales de laboratorio a una infección con el virus de la coriomeningitis linfocítica y descubrió, finalmente, que derivaban de las células T CD8 +, conocidas como citotóxicas o asesinas. Estas son fundamentales en la defensa contra patógenos y células cancerosas.
“En respuesta a la infección, las células T CD8 + vírgenes producen un gran conjunto de células efectoras terminales de vida corta que eliminan las células huésped infectadas”, escribieron los autores de la investigación.
“Paralelamente, se forma una población menor de células de memoria central, similares a las células madre, que tienen la capacidad de mantener la inmunidad después de la eliminación del patógeno”, añadieron.
Ver más información: Gomes Silva J, Pais Ferreira D, Dumez A, Wyss T, Veber R, Danilo M,et al. Emergence and fate of stem cell–like Tcf7+ CD8+ T cells during a primary immune response to viral infection.Sci. Immunol[Internet].2023[citado 3 ene 2024].DOI:10.1126/sciimmunol.adh3113
4 ene 2024|Fuente: Cubadebate| Tomado de| Ciencia y Tecnología
dic
8
 Un equipo internacional de científicos ha descubierto por primera vez cómo se organizan las células de un embrión para formar las extremidades humanas, lo que ayudará en el futuro a diagnosticar y a tratar las enfermedades congénitas asociadas a las mismas.
Un equipo internacional de científicos ha descubierto por primera vez cómo se organizan las células de un embrión para formar las extremidades humanas, lo que ayudará en el futuro a diagnosticar y a tratar las enfermedades congénitas asociadas a las mismas.
El hallazgo, que publica este miércoles la revista Nature, ha sido posible gracias a la aplicación de tecnologías celulares de vanguardia para crear un atlas que caracteriza el mapa celular de las extremidades humanas desde que empiezan a formarse. De este modo, los investigadores han visto cómo las extremidades se crean en una fase inicial como una especie de bolsas celulares indiferenciadas a los lados del cuerpo, sin una forma o función específicas.
Es a las ocho semanas de desarrollo cuando empiezan a estar bien diferenciadas, son anatómicamente complejas e inmediatamente reconocibles como extremidades, con dedos en las manos y en los pies. Este proceso requiere ‘una orquestación muy rápida y precisa de las células’, subraya el estudio, ya que cualquier pequeña alteración durante este proceso puede tener un efecto secundario, razón por la cual las variaciones en las extremidades se encuentran entre los síndromes más frecuentes al nacer, afectando aproximadamente a uno de cada 500 bebés en todo el mundo.
Para llegar a esta conclusión, los investigadores analizaron tejidos humanos de entre 5 y 9 semanas de desarrollo, lo que les permitió rastrear programas específicos de expresión génica, activados en determinados momentos y zonas, que dan forma a las extremidades en formación. Como parte del estudio, los investigadores demostraron que hay patrones genéticos con implicaciones en la formación de las manos y los pies, identificando ciertos genes que, cuando se alteran, se asocian a síndromes específicos de las extremidades como la braquidactilia -dedos cortos- y la polisindactilia -dedos de más o de menos-.
El equipo también pudo confirmar que muchos aspectos del desarrollo de las extremidades son comunes a humanos y ratones. En conjunto, estos hallazgos no solo proporcionan una caracterización en profundidad del desarrollo de las extremidades en humanos, sino que también aportan datos fundamentales que podrían influir en el diagnóstico y tratamiento de los síndromes congénitos de las extremidades. ‘Lo que revelamos es un proceso muy complejo y regulado con precisión. Es como ver trabajar a un escultor que va cincelando un bloque de mármol hasta revelar una obra maestra. En este caso, la naturaleza es la escultora, y el resultado es la increíble complejidad de nuestros dedos’, ha señalado uno de los autores, Hongbo Zhang, investigador de la Universidad Sun Yat-sen de Guangzhou en un comunicado.
Este estudio forma parte de la iniciativa internacional Atlas Celular Humano, cuyo objetivo es cartografiar todos los tipos celulares del cuerpo humano para transformar la comprensión de la salud y la enfermedad, y ha sido llevado a cabo por investigadores del Instituto Wellcome Sanger, el Instituto Europeo de Bioinformática (ambos en el Reino Unido), la Universidad Sun Yat-sen (China), además de colaboradores de otros centros. ‘Nuestro trabajo en el Atlas Celular Humano está profundizando nuestra comprensión de cómo se forman estructuras anatómicamente complejas, ayudándonos a descubrir los procesos genéticos y celulares que subyacen al desarrollo humano sano, con muchas implicaciones para la investigación y el tratamiento de las enfermedades’, ha señalado la autora Sarah Teichmann, doctora en el Instituto Wellcome Sanger y cofundadora del Atlas de Células Humanas.
Ver más información: Zhang B, He P, Lawrence JEG, Wang S, Tuck E, Williams BA, et al. A human embryonic limb cell atlas resolved in space and time. Nature [Internet]. 2023[citado 7 dic 2023];. https://doi.org/10.1038/s41586-023-06806-x
8 diciembre 2023|Fuente: EFE| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
dic
4
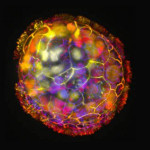 Las células de la tráquea de adultos sanos han servido para crear un diminuto robot biológico, bautizados como ‘anthrobots’, que en una placa de laboratorio pueden moverse y estimular el crecimiento de neuronas en cultivo que están dañadas.
Las células de la tráquea de adultos sanos han servido para crear un diminuto robot biológico, bautizados como ‘anthrobots’, que en una placa de laboratorio pueden moverse y estimular el crecimiento de neuronas en cultivo que están dañadas.
La creación de estos robots, que varían en tamaño desde el ancho de un cabello hasta la punta de un lápiz afilado y fueron hechos para autoensamblarse, es el resultado de una investigación de las universidades de Tufts y Harvard (EE.UU.) que dan los detalles en un estudio que publica Advances in Science.
El descubrimiento es un punto de partida para la visión de los investigadores de utilizar biobots derivados de pacientes como nuevas herramientas terapéuticas para la regeneración, la curación y el tratamiento de enfermedades, destacó la Universidad de Tufts.
Esta investigación sucede a otra publicada en 2020, en la que un equipo logró construir milimétricos robots ensamblados a partir de células embrionarias de ranas, llamados ‘xenobots’ y capaces de recolectar material, registrar información, curarse a sí mismos e incluso replicarse durante algunos ciclos por sí solos.
Los investigadores no sabían si esas capacidades dependían de que derivaran de un embrión de anfibio o si los biobots podrían construirse a partir de células de otras especies. Ahora, el equipo ha descubierto que este tipo de robots biológicos pueden crearse a partir de células adultas humanas sin ninguna modificación genética y que muestran capacidades más allá de lo observado con los ‘xenobots’.
Para su estudio, emplearon células humanas de la tráquea a las que dieron la oportunidad de reiniciarse y encontrar formas de crear nuevas estructuras y tareas. De hecho, crearon nuevas formas multicelulares y podían moverse de diferentes maneras sobre una superficie de neuronas humanas cultivadas en una placa de laboratorio, así como estimular un nuevo crecimiento para llenar los huecos causados al raspar la capa de células.
Los ‘anthrobots’ fomentan el crecimiento de las neuronas, pues estas crecían bajo la zona cubierta por un conjunto agrupado de estos robots biológicos, al que llamaron ‘superbot’, y no lo hicieron en las zonas donde no estaban. Al menos en el simplificado mundo 2D de la placa de laboratorio, los conjuntos de ‘anthrobots’ fomentaron la cicatrización eficaz del tejido neuronal vivo, agrega la universidad en un comunicado.
Aunque los investigadores aún no saben exactamente cómo lo logran, ahora están analizando cómo funciona ese mecanismo de curación y se preguntán qué más pueden hacer estas construcciones, señaló Michael Levin, firmante del artículo y de la Universidad de Tufts. Para Levin es ‘fascinante y completamente inesperado que las células traqueales de pacientes normales, sin modificar su ADN, puedan moverse por sí solas y estimular el crecimiento neuronal a través de una región dañada’. Una ventaja de utilizar células humanas incluye la capacidad de construir robots a partir de las propias del paciente para realizar trabajos terapéuticos sin el riesgo de desencadenar una respuesta inmune o requerir inmunosupresores.
Estos robots biológicos solo duran de 45 a 60 días antes de descomponerse de forma natural, por lo que el cuerpo puede reabsorberlos fácilmente una vez acabado su trabajo. Fuera del cuerpo solo pueden sobrevivir en condiciones de laboratorio muy específicas, por lo que no hay riesgo de exposición o propagación involuntaria fuera de esas instalaciones. Además, no se reproducen y no tienen ediciones, adiciones o eliminaciones genéticas, por lo que no hay riesgo de que evolucionen más allá de las salvaguardas existentes, asegura la universidad.
Para crear uno de estos ‘anthrobots’ se comienza con una célula derivada de un donante adulto procedente de la superficie de la tráquea. Estás células están cubiertas por proyecciones parecidas a pelos llamadas cilios que se mueven hacia adelante y hacia atrás. Los investigadores desarrollaron condiciones de crecimiento que animaban a los cilios a mirar hacia fuera en los organoides y a los pocos días empezaron a moverse, impulsados por los cilios que actuaban como remos. Los ‘anthrobots’ se autoensamblan en la placa de laboratorio y, a diferencia de los ‘xenobots’, no necesitan pinzas ni bisturís para darles forma, explicó Gizem Gumuskaya, también firmante de la investigación.
El equipo considera que un mayor desarrollo de los robots podría dar lugar a otras aplicaciones, como la eliminación de la placa acumulada en las arterias de pacientes con aterosclerosis, la reparación de daños en la médula espinal o los nervios de la retina, el reconocimiento de bacterias o células cancerosas, o el suministro de fármacos a tejidos específicos.
Ver más información: Gumuskaya G, Srivastava P, Cooper BG, Lesser H, Semegran B, Garnier S. Motile Living Biobots Self-Construct from Adult Human Somatic Progenitor Seed Cells. Adv Sci [Internet]. 2023[citado 2 dic 2023]; 2303575. https://doi.org/10.1002/advs.202303575
4 diciembre 2023 |Fuente: EFE| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.

