ago
28
 Este trabajo, para el que se requiere una importante potencia informática, podría ayudar contra otras enfermedades causadas por virus similares, como el zika y la fiebre amarilla.
Este trabajo, para el que se requiere una importante potencia informática, podría ayudar contra otras enfermedades causadas por virus similares, como el zika y la fiebre amarilla.
Los flavivirus (dengue, zika, virus del Nilo Occidental, fiebre amarilla…) infectan las células humanas por un proceso llamado endocitosis (fusionan su membrana con la pared celular en función de la acidez que detectan). Conocer este mecanismo es clave para obtener fármacos antivirales que eviten la infección y, dado que la interacción entre los virus y las células sanas se produce a través de proteínas muy complejas, para entender el proceso es necesario simular por ordenador cómo se produce la interacción química entre sus moléculas.
Con este enfoque, un estudio de la Universidad Miguel Hernández (UMH) de Elche, publicado en la revista Biochimica Biophysica Acta Biomembranes, ha revelado la secuencia específica de la proteína E del virus del dengue donde se produce la interacción con las células humanas y, por tanto, hacia dónde deberían dirigirse los fármacos para prevenir la infección, según destaca José Villalaín, líder del estudio y profesor de Bioquímica y Biología Molecular de la UMH.
¿Cuál es el punto de partida del proyecto? El virus del dengue ya es endémico en nuestro país, al detectarse casos autóctonos. Según Villalaín, investigador del Instituto de Desarrollo, Investigación e Innovación en Biotecnologías Sanitaria de la Universidad Miguel Hernández (IdiBE), es de esperar que se produzcan cada vez más casos debido a las altas temperaturas y a las inundaciones periódicas que favorecen la extensión y propagación de los mosquitos Aedes aegypti o Aedes albopictus, cuya picadura puede transmitir la enfermedad.
Anteriores publicaciones de Villalaín demostraron que la proteína E del virus del dengue, responsable de la entrada del virus en la célula huésped, tiene tres puntos de unión a las membranas biológicas. A partir de ese conocimiento, ya que la fusión de las membranas es el primer y más importante paso en la infección del virus del dengue, era necesario «afinar» aún más dónde podía producirse el proceso.
Primera vacuna que protege contra el dengue con independencia de infecciones previas
‘Luz verde’ de la EMA a la vacuna tetravalente contra el dengue de Takeda
Cataluña confirma un nuevo caso de dengue no importado en España
Este estudio se ha realizado mediante dinámica molecular, un proceso de «simulación virtual» de la interacción entre proteínas que requiere tanta potencia informática que resulta necesario un conjunto de ordenadores para llevar a cabo el experimento. En estas simulaciones, se puede ver cómo se comporta cada átomo que compone las proteínas del virus y, por tanto, estudiar en detalle tanto la interacción entre moléculas como lo que ocurre dentro de las mismas.
Para este tipo de investigaciones, la UMH cuenta con un clúster de computación científica, un grupo de ordenadores unidos mediante una red de alta velocidad, gestionada por el Servicio de Innovación y Planificación Tecnológica. Según Villalaín, «se analizaron diversas conformaciones proteicas del sensor de pH y su interacción con diferentes lípidos de la membrana. Debido a la complejidad de los sistemas la toma de datos duró unos seis meses».
Gracias a esa labor, se ha demostrado que existe una secuencia específica de la proteína E del virus del dengue que es responsable tanto de la interacción proteína-proteína como proteína-membrana, fundamental en el proceso de activación proteica y en la consecuente fusión de las membranas viral y celular. Ese segmento, además de funcionar como sensor de pH, es decir, ser capaz de detectar la entrada del virus dentro del endosoma tardía, se une a la biomembrana de la célula con una alta afinidad y gran especificidad, lo que lo convierte en una diana terapéutica fundamental con la cual atacar al virus. Respecto al resultado, Villalaín destaca que «no se sabía si solo funcionaba como sensor de pH y/o además interaccionaba con la membrana de un modo específico, como así se ha demostrado».
Aplicación a otros virus similares
La importancia adicional del trabajo radica en que este segmento, encontrado también en otros tipos similares de virus, podría ayudar a encontrar moléculas antivirales que también serían efectivas contra las infecciones de virus similares al dengue, como el zika o la fiebre amarilla. Ese hallazgo, en definitiva, «nos descubre una nueva diana para poder inhibir la entrada del virus del dengue y, posiblemente, la de otros flavivirus». En todas estas patologías, recuerda, «no existen vacunas, son ineficientes o incluso producen efectos secundarios a determinados tipos de paciente». Todo ello podría ayudar a «conseguir un antiviral de efecto genérico contra los flavivirus», además de «estar preparados para nuevos tipos de virus emergentes de la misma familia que, posiblemente, a medio y largo plazo puedan ser generadores de nuevas enfermedades».
Fuente: Diario Médico
ago
28
 La preeclampsia, que es un aumento de la presión arterial que pone en riesgo la vida, es una afección enigmática. Cada año, causa la muerte de más de 70 000 mujeres en todo el mundo. Dado que los científicos no conocen sus causas, carecen de estrategias específicas para tratarla.
La preeclampsia, que es un aumento de la presión arterial que pone en riesgo la vida, es una afección enigmática. Cada año, causa la muerte de más de 70 000 mujeres en todo el mundo. Dado que los científicos no conocen sus causas, carecen de estrategias específicas para tratarla.
El parto, el único tratamiento disponible, a menudo no es la cura ideal, según la Dra. en Ciencias Vesna D. Garovic, nefróloga de Mayo Clinic en Rochester, Minnesota, que ha dedicado su carrera a estudiar esta complicación común durante el embarazo.
«Incluso después del parto, las mujeres pueden tener una presión arterial peligrosamente alta durante muchos días o semanas», dice la Dra. «Y siguen corriendo un riesgo elevado de padecer enfermedades cardiovasculares y renales décadas después».
A través de una combinación de experimentos de laboratorio y estudios epidemiológicos, la Dra. Garovic ha demostrado que las mujeres con preeclampsia experimentan un estado de envejecimiento acelerado que las lleva a desarrollar afecciones relacionadas con la edad, como ataques cardíacos, accidentes cerebrovasculares e insuficiencias renales.
Su investigación está revelando un posible mecanismo detrás de la preeclampsia que podría llevar a la obtención de la primera terapia diseñada para tratar una causa subyacente de la afección. También destaca la importancia de aumentar los exámenes de detección y el tratamiento para las mujeres con antecedentes de preeclampsia.
La mayoría de las investigaciones sobre la preeclampsia se basan en la premisa de que la enfermedad se origina en la placenta, el órgano que se materializa con cada embarazo para proteger y alimentar al bebé en desarrollo. Los investigadores creen que, en la preeclampsia, la placenta secreta moléculas en el sistema circulatorio de la madre que causan inflamación e interfieren con la formación de nuevos vasos sanguíneos, un proceso conocido como angiogénesis. Se cree que estas moléculas dañinas pueden causar enfermedades sistémicas en la persona embarazada.
La meta ha sido identificar la molécula o las moléculas responsables, dice la Dra. Garovic.
Durante décadas, los investigadores han notado que las placas extraídas de embarazos de mujeres con preeclampsia a menudo mostraban signos de que estaban envejeciendo más rápido que las placentas extraídas de los embarazos normales: «Sin embargo, era contradictorio decir que la preeclampsia era una enfermedad del envejecimiento cuando estábamos observando a alguien de 25 años», dice la Dra. Garovic.
De hecho, muchas de las moléculas que se elevaban en los embarazos de mujeres con preeclampsia eran marcadores bien conocidos de la senescencia, un estado celular que literalmente significa «el proceso de envejecimiento». La Dra. Garovic teorizó que la senescencia puede ser la vía por la que algunas mujeres desarrollan preeclampsia. Las células senescentes dejan de dividirse, pero no mueren y no siempre se eliminan del organismo. En cambio, a veces se acumulan en los tejidos y secretan moléculas dañinas.
Usando muestras y datos del Proyecto de Epidemiología de Rochester, la Dra. Garovic ha rastreado varios signos de envejecimiento y senescencia tanto en mujeres que padecen preeclampsia en el embarazo como en las que no. Junto con los ginecólogos obstetras de Mayo Clinic, la Dra. Wendy White y la Dra. Yvonne Butler Tobah, descubrió que las mujeres que han tenido preeclampsia tienen una mayor cantidad de afecciones crónicas más adelante en la vida, y las desarrollan a una edad mucho más temprana, que las mujeres sin antecedentes de preeclampsia.
También se asoció con los expertos en senescencia celular de Mayo Clinic, el Dr. en Ciencias James Kirkland y la Dra. Tamara Tchkonia, para demostrar que las mujeres con preeclampsia experimentan un envejecimiento acelerado durante el embarazo, como lo demuestra el reloj epigenético. Estos relojes epigenéticos permiten a los investigadores calcular el envejecimiento biológico de la sangre y otros tejidos mediante la medición de la acumulación de marcas de metilo, que cambian con el tiempo en cualquier organismo, en cientos de sitios del genoma.
Los investigadores descubrieron que durante sus embarazos y en el momento del parto, las mujeres con preeclampsia habían envejecido un promedio de 2,4 años más rápido que las mujeres sin la complicación del embarazo.
La Dra. Garovic tiene la esperanza de que los nuevos medicamentos que se desarrollan en el campo de la senescencia algún día demuestren ser seguros para usarse durante el embarazo, lo que proporcionaría más opciones a las mujeres en riesgo.
Incluso si no hay tratamientos específicos disponibles en este momento para atacar las células senescentes en mujeres con antecedentes de preeclampsia, la Dra. Garovic cree que la investigación sobre las asociaciones entre esta complicación del embarazo y los problemas médicos futuros tendrá un gran impacto.
Sus estudios y otros ya están dando lugar a nuevas pautas para los exámenes de detección y el tratamiento de las mujeres en riesgo, con el objetivo final de mejorar los resultados y salvar vidas. Por ejemplo, la Dra. Garovic formó parte de un grupo de trabajo de la Asociación Americana del Corazón que examinaba la hipertensión en el embarazo y escribió la declaración científica de la asociación, que pedía que se realizara más trabajo para proteger a las mujeres de las complicaciones de los embarazos con hipertensión y las posibles consecuencias posteriores al embarazo.
«Con respecto a las mujeres que han tenido preeclampsia, es necesario controlar su presión arterial, colesterol y función renal», dice la Dra. «Debemos hacer un seguimiento de su IMC y peso e intentar controlar sus modificaciones en el estilo de vida y la salud a largo plazo».
Para obtener más información, consulte Discovery’s Edge de Mayo Clinic.
Fuente: EurekaAlert
Referencia:
Suvakov S, Ghamrawi R, Cubro H, Tu H, White WM, Tobah YSB, et al. Epigenetic and senescence markers indicate an accelerated ageing-like state in women with preeclamptic pregnancies. EBioMedicine. 2021 Aug; 70:103536. doi: 10.1016/j.ebiom.2021.103536. Epub 2021 Aug 11. PMID: 34391091; PMCID: PMC8365351 https://pubmed.ncbi.nlm.nih.gov/34391091/
ago
28
 Un veinte por ciento de las mujeres encuestadas reportó experiencias de maltrato durante la atención en el embarazo y el parto, según un nuevo informe de Signos Vitales de los CDC. El maltrato durante la atención de maternidad fue más alto entre las mujeres de raza negra (30 %), hispanas (29 %) y multirraciales (27 %). Read more
Un veinte por ciento de las mujeres encuestadas reportó experiencias de maltrato durante la atención en el embarazo y el parto, según un nuevo informe de Signos Vitales de los CDC. El maltrato durante la atención de maternidad fue más alto entre las mujeres de raza negra (30 %), hispanas (29 %) y multirraciales (27 %). Read more
ago
24
Un reciente estudio revela el mecanismo por el que una mutación en el gen ACTA2 predispone al desarrollo temprano de enfermedad coronaria en ausencia de factores de riesgo cardiovascular como los niveles elevados de colesterol en sangre.
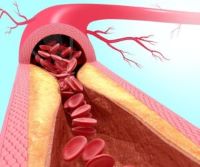 Una mutación en el gen ACTA2 deriva en la formación de placas ateroscleróticas en la aorta y mayor riesgo de enfermedad coronaria, independientemente de los niveles de colesterol y otras grasas. Un reciente estudio revela por qué.
Una mutación en el gen ACTA2 deriva en la formación de placas ateroscleróticas en la aorta y mayor riesgo de enfermedad coronaria, independientemente de los niveles de colesterol y otras grasas. Un reciente estudio revela por qué.
Desde su identificación en 2009, la mutación p.Arg149Cys del gen ACTA2 ha planteado un enigma para los investigadores. Como otras mutaciones en el gen ACTA2, p.Arg149Cys predispone al desarrollo de enfermedad torácica aórtica. Además, esta mutación aumenta el riesgo a desarrollar enfermedad coronaria de forma prematura (a los 30 años o antes) en personas que no presentan factores de riesgo cardiovascular.
“El gen ACTA2 codifica una proteína específica que no tiene nada que ver con el colesterol”, ha señalado Dianna Milewicz, profesora y directora de la División de Genética Médica en la Escuela de Medicina McGovern en UTHealth Houston. “Fue una sorpresa descubrir que las personas con la mutación genética tenían demasiada aterosclerosis a una edad temprana y sin factores de riesgo.”
Recientemente, a partir de diferentes estudios en ratón, el equipo de Milewicz ha identificado cómo se produce el efecto patogénico de p.Arg149Cys, mecanismo que tiene repercusiones clínicas para el tratamiento de algunos pacientes con enfermedad cardiovascular. Los resultados se han publicado en la revista European Heart Journall.
De la mutación al mecanismo de patogenicidad
ACTA2 codifica para SMA, una proteína del citoesqueleto de las células musculares que recubren los vasos sanguíneos. Como elemento estructural necesario para la contracción de estas células, su conexión con la aterosclerosis que provoca la enfermedad coronaria no estaba clara en un principio.
Para resolver el papel de la mutación p.Arg149Cys en la aterosclerosis, en primer lugar, el equipo confirmó en ratones modelo que la presencia de la mutación deriva en la formación de placas ateroscleróticas en la aorta, independientemente de los niveles de colesterol y otras grasas.
A continuación, a partir de diferentes experimentos (estudio histopatológico, estudios celulares, análisis de expresión y otros) los investigadores analizaron en detalle los efectos de la mutación p.Arg149Cys.
A partir de la información obtenida los investigadores han establecido que el cambio de aminoácido que produce la mutación da lugar a un mal plegamiento de la proteína, que activa una respuesta de estrés en las células. Este estrés fuerza a las células a producir más colesterol en su interior, independientemente de cuánto colesterol haya en la sangre. Finalmente, el aumento en los niveles de colesterol (en este caso internos) deriva en la formación de las placas ateroscleróticas que comprometen el flujo sanguíneo y derivan en la enfermedad cardiovascular.
Implicaciones terapéuticas del estudio
La identificación del estrés intracelular de las células musculares de los vasos sanguíneos como un nuevo mecanismo que puede dar lugar a aterosclerosis, tiene diversas implicaciones relevantes a nivel clínico.
“Este hallazgo es único en el sentido de que hemos descubierto una vía completamente nueva hacia la aterosclerosis. Esto explica por qué durante años hemos sabido que las estatinas protegen a las personas de los ataques cardíacos, incluso a aquellas cuyos niveles de colesterol en sangre son normales. En las personas con mutaciones en el gen ACTA2, las estatinas bloquean el colesterol producido por las células musculares lisas estresadas”, ha señalado Milewicz, director del estudio.
De hecho, en los ratones modelo, el equipo detectó que el tratamiento con la estatina pravastatina revertía el aumento de aterosclerosis. “Estos resultados tienen implicaciones directas para el manejo de los individuos en riesgo de enfermedad coronaria que no tienen hipercolesterolemia”, concluyen los autores del estudio. “Estos datos apoyan la utilización terapéutica de estatinas en pacientes con variantes en el gen ACTA2 en ausencia de hipercolesterolemia”.
Puesto que el estrés de las células musculares lisas asociadas a la aterosclerosis deriva en el depósito de calcio en las arterias, Milewicz también plantea que estudiar esta característica mediante imagen podría ser útil para diagnosticar de forma temprana o monitorizar el desarrollo de aterosclerosis temprana en las personas con mutaciones en ACTA2. “Esto permitiría a los médicos decidir a qué edad pueden empezar estos pacientes con estatinas”, señala el investigador.
Nuevas cuestiones para estudios futuros
Los resultados del trabajo también plantean preguntas a resolver en estudios futuros. “En nuestro estudio, la proteína mutante producida por la mutación de ACTA2 provocó que las células en la pared de la arteria estuvieran estresadas, pero hay muchos otros factores que pueden estresar a las células. Ahora estamos investigando los factores de riesgo de la enfermedad de las arterias coronarias, como la hipertensión, que también estresarían a las células y activarían esta nueva vía para la enfermedad de las arterias coronarias.”
Además, puesto que la proteína SMA se expresa prácticamente solo en las células musculares de los vasos sanguíneos, los investigadores plantean que podría haber otras variantes que tuvieran un efecto similar.
Fuente: Genética Médica News
Referencia: Kaw K, et al. Smooth muscle α-actin missense variant promotes atherosclerosis through modulation of intracellular cholesterol in smooth muscle cells. Eur Heart J. 2023 Jun 28:ehad373. doi: http://dx.doi.org/10.1093/eurheartj/ehad373https://academic.oup.com/eurheartj/article/44/29/2713/7209229?login=false
ago
24
Investigadores de la Universidad de Berlín han identificado un marcador epigenético en el gen POMC relacionado con el riesgo elevado a tener sobrepeso en mujeres que abre una posibilidad terapéutica para algunos pacientes con obesidad. Read more
ago
24
 Investigadores de la Universidad de Cambridge han obtenido las primeras evidencias de que, durante el embarazo, el feto utiliza un gen paterno para controlar el suministro de nutrientes desde la placenta.
Investigadores de la Universidad de Cambridge han obtenido las primeras evidencias de que, durante el embarazo, el feto utiliza un gen paterno para controlar el suministro de nutrientes desde la placenta.
Durante el embarazo, el metabolismo materno se adapta para suministrar nutrientes que favorezcan el crecimiento y desarrollo fetal. La placenta, órgano temporal formado por células del feto y de la madre, actúa como intermediaria entre la madre y el feto y facilita el intercambio de nutrientes y oxígeno entre ambos. Conforme progresa el embarazo, el feto aumenta sus demandas de nutrientes para promover su crecimiento, lo que se opone, en cierto modo, a las necesidades maternas de mantener los nutrientes necesarios para su salud y prepararse para la lactancia y posibles posteriores embarazos.
A partir de estudios en ratones un equipo de la Universidad de Cambridge ha encontrado que IGF2, una señal endocrina similar a la insulina, modifica el metabolismo materno y distribución de recursos hacia el feto. Además, la señalización mediada por Igf2 participa en el desarrollo de diversos tejidos como la placenta, el hígado y el cerebro. En un estudio previo, el equipo había identificado el papel de IGF2 en el desarrollo de la vasculatura de la placenta para adaptarse al crecimiento del embrión.
Un gen de expresión paterna
Interesantemente, IGF2 está codificada por un gen con impronta genómica, de forma que únicamente la copia paterna está activa en la placenta. “Si la función de Igf2 del padre es inactivada en las células señalizadoras, la madre no produce suficiente cantidad de glucosa y lípidos disponible para su circulación”, señala Jorge Lopez-Tello, Investigador en el Departamento de Fisiología, Desarrollo y Neurociencia, así como primer firmante del trabajo, publicado en Cell Metabolism. “Por lo tanto, estos nutrientes llegan al feto en cantidades insuficientes y el feto no crece adecuadamente”.
Los investigadores plantean que la expresión de Igf2 con impronta genética en la placenta puede haber evolucionado como una estrategia para movilizar nutrientes hacia el feto en crecimiento. En este contexto, Igf2 y placenta tienen un papel central en el conflicto materno-fetal por los recursos maternos.
Impacto a largo plazo de los defectos en Igf2
Los investigadores también han determinado que la reducción en la señalización mediada por Igf2 en la placenta tiene consecuencias metabólicas postnatales. Los ratones deficientes para Igf2 mostraron un crecimiento restringido e hipoglucémico, con efectos que se extendieron a la edad adulta.
“Nuestra investigación pone de relieve lo importante que es la distribución controlada de nutrientes hacia el feto para la salud de la descendencia a lo largo de toda su vida, y el papel directo que desempeña la placenta”, ha señalado Amanda Sferruzzi, catedrática en Fisiología Fetal y de la Placenta en la Universidad de Cambridge. “La placenta es un órgano asombroso. Al final del embarazo, la madre expulsa la placenta, pero los recuerdos de cómo estaba funcionando la placenta dejan un legado duradero en la forma en que se han desarrollado los órganos fetales y en cómo van a funcionar a lo largo de la vida”.
El siguiente paso de los investigadores será determinar con mayor detalle cómo Igf2 controla las hormonas de la placenta implicadas en regulación de nutrientes y crecimiento de los órganos e identificar la función exacta de estas hormonas.
Fuente: Genética Médica News
Referencia: Lopez-Tello J, et al. Fetal manipulation of maternal metabolism is a critical function of the imprinted Igf2 gene. Cell Metab. 2023 Jul 11;35(7):1195-1208.e6. doi: http://dx.doi.org/10.1016/j.cmet.2023.06.007
https://www.sciencedirect.com/science/article/pii/S1550413123002176?via%3Dihub

