may
7
 El Ministerio de Salud Pública de Ecuador informó hoy que a partir del próximo 12 de mayo exigirá certificado de vacunación contra la fiebre amarilla a viajeros provenientes de Bolivia, Brasil, Colombia y Perú.
El Ministerio de Salud Pública de Ecuador informó hoy que a partir del próximo 12 de mayo exigirá certificado de vacunación contra la fiebre amarilla a viajeros provenientes de Bolivia, Brasil, Colombia y Perú.
Mediante un comunicado divulgado este jueves, las autoridades sanitarias indicaron que la medida busca fortalecer la prevención y el control de la circulación del virus.
Por esa razón, deberán presentar el Certificado Internacional de Vacunación contra esta enfermedad nacionales o residentes en esos cuatro países, así como ciudadanos de otras nacionalidades que hayan permanecido más de 10 días en tránsito o visita en dichas naciones antes de ingresar a Ecuador.
Precisaron que el certificado debe indicar que la inmunización fue recibida al menos 10 días antes del viaje.
Además, recomendaron a los ecuatorianos sin antecedente vacunal a recibir la dosis única contra la enfermedad en caso de necesitar trasladarse a zonas de riesgo en la Amazonía.
Hasta la fecha, Ecuador registra tres casos detectados de fiebre amarilla y un fallecido.
01 mayo 2025 | Fuente: Prensa Latina | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
may
6
 El Fondo de las Naciones Unidas para la Infancia (Unicef) alertó hoy que los brotes de sarampión están en aumento, pues en el año 2024, se registraron más de 359 521 casos en el mundo, pero evitarlos está en la vacunación. El sarampión es una enfermedad vírica muy contagiosa, con consecuencias que pueden ser mortales para los niños y niñas pequeños, subrayó.
El Fondo de las Naciones Unidas para la Infancia (Unicef) alertó hoy que los brotes de sarampión están en aumento, pues en el año 2024, se registraron más de 359 521 casos en el mundo, pero evitarlos está en la vacunación. El sarampión es una enfermedad vírica muy contagiosa, con consecuencias que pueden ser mortales para los niños y niñas pequeños, subrayó.
Señaló que hay demasiados lugares, donde el sarampión se está propagando por las bajas coberturas de inmunización.
En los últimos cinco años aparecieron brotes de sarampión en más de 100 países, donde viven aproximadamente el 75 % de todos los niños y niñas del mundo, agregó.
«Pero la buena noticia es que podemos frenar la propagación del sarampión y erradicar la enfermedad en todo el mundo», enfatizó por medio de su perfil en la red X.
Recalcó que las vacunas contra el sarampión son seguras y eficaces y constituyen la mejor forma de evitar que los niños y niñas padezcan la enfermedad y la contagien a otras personas. Dos dosis de una vacuna contra el sarampión ofrecen 99 % ciento de protección frente a la enfermedad de por vida, precisó.
Recordó que desde 1974, las vacunas contra esa enfermedad salvaron unos 94 millones de vidas y han protegido a más personas que cualquier otra de las vacunas del Programa Esencial de Inmunización.
Pese a que hoy en día la mayoría de los países ya han incluido las vacunas contra el sarampión en sus calendarios de vacunación, aún hay demasiados niños y niñas que no han sido inmunizados, manifestó.
«En su mayoría, las causas de que los niños y niñas no se vacunen tienen que ver con la desigualdad, la pobreza y la escasez de servicios en las comunidades», remarcó.
29 abril 2025 | Fuente: Prensa Latina | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
may
5
 Autoridades de salud de México mantienen hoy la vigilancia y el llamado a la población a vacunarse ante la incidencia de sarampión, con 583 casos confirmados, y de tos ferina, con 809 enfermos y 48 defunciones.
Autoridades de salud de México mantienen hoy la vigilancia y el llamado a la población a vacunarse ante la incidencia de sarampión, con 583 casos confirmados, y de tos ferina, con 809 enfermos y 48 defunciones.
El secretario de Salud, David Kershenobich, detalló que hasta la semana 16 de este año los especialistas reportaron los casos de sarampión en Campeche (cuatro), Chihuahua (560), Durango (tres), Oaxaca (cuatro), Querétaro (uno), Sinaloa (uno), Sonora (cinco), Tamaulipas (dos), y Zacatecas (tres).
«Estamos reforzando la vigilancia epidemiológica y la búsqueda activa» de posibles enfermos, afirmó el titular, al referir igualmente que de los 2 019 pacientes probables de sarampión, se descartaron 964 y continúan en estudio 472.
De acuerdo con el funcionario, el padecimiento se presenta en forma semejante en cuanto a la distribución por sexo entre hombres y mujeres, mientras el número mayor de casos (35,7 %), se ubica entre los 25 y 44 años de edad, y el siguiente por cantidad (13,9) en el de uno a cuatro.
«Lo que es importante y vemos en esta lámina es que la mayor parte de los casos, 542, no habían sido vacunados; 24 casos solo habían recibido una de las dos dosis y 17 casos sí habían recibido las dos dosis de vacunación», señaló Kershenobich, al insistir en la relevancia de esos inyectables.
«Hemos logrado contener los casos de sarampión con un cerco vacunal alrededor de donde se detectan», destacó.
Acerca de la tos ferina, el secretario aludió a la detección de 809 enfermos distribuidos en todo el país, fundamentalmente en esta capital y en el estado de Nuevo León, además de Chihuahua, estos dos últimos situados en la frontera norte.
«De esos casos hemos tenido desafortunadamente 48 defunciones en niños menores de un año», informó el titular al subrayar que la vacuna se aplica por primera vez al año e instar a las mujeres embarazadas a ponérsela a partir de la semana 20 para transmitir la inmunidad a los pequeños.
«Entonces, el grupo de riesgo en particular en que nos estamos enfocando, además de los niños, tiene que ver precisamente con las mujeres embarazadas en la semana 20, hayan o no recibido la vacuna con anterioridad para la tos ferina», apuntó.
La autoridad recordó, asimismo, la realización de la Semana Nacional de Vacunación, iniciada el pasado sábado y que concluirá el 3 de mayo, y aseguró la existencia de suficientes biológicos para continuar con el programa habitual una vez concluya esta jornada.
«Estamos en la primera Semana Nacional de Vacunación de 2025. Eso no quiere decir que nada más se vacune en esta semana, sino que esta semana nos sirve para levantar la conciencia entre toda la población de la importancia de vacunarse», enfatizó.
29 abril 2025 | Fuente: Prensa Latina | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
abr
22
 México registra hasta hoy un total de 362 casos de sarampión, la mayor parte en el norteño estado de Chihuahua, fronterizo con Estados Unidos, y un fallecimiento, informó el secretario de Salud David Kershenobich.
México registra hasta hoy un total de 362 casos de sarampión, la mayor parte en el norteño estado de Chihuahua, fronterizo con Estados Unidos, y un fallecimiento, informó el secretario de Salud David Kershenobich.
Al intervenir en el habitual encuentro de la presidenta Claudia Sheinbaum con periodistas, el titular precisó que además de los 347 detectados en Chihuahua en lo transcurrido del año, también se han reportado en las entidades de Campeche, Oaxaca, Sinaloa, Sonora, Querétaro y Zacatecas.
De acuerdo con el funcionario, en todas esas demarcaciones las autoridades contuvieron los casos alrededor de donde se ha diagnosticado, pero a la vez implementaron el programa de prevención en forma muy activa y de enero a marzo aplicaron 715 277 vacunas.
Kershenobich mencionó que ha habido cinco hospitalizaciones y una defunción, aunque en este último caso se trató de un paciente que no solo padecía sarampión, sino que tenía daño renal y orgánico y comorbilidades como diabetes.
El secretario de Salud mostró un gráfico donde la tendencia en los casos es hacia la baja, pero insistió en la importancia de que los ciudadanos se vacunen.
«Volver a recomendar el esquema de vacunación, que tiene que abarcar a niños de uno a nueve años, también los adolescentes y adultos entre 10 y 39 años, todo el personal de salud de 20 a 39 años en contacto con casos positivos», señaló.
Recordó la realización del 26 de abril al 3 de mayo de la Semana Nacional de Vacunación.
15 abril 2025 | Fuente: Prensa Latina | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
abr
18
 La Agencia Nacional de Vigilancia Sanitaria (Anvisa), el ente regulador de Brasil, aprobó hoy lunes el registro definitivo de la vacuna contra el chikungunya, producto de una investigación del estatal Instituto Butantan brasileño con el laboratorio farmacéutico franco-austríaco Valneva.
La Agencia Nacional de Vigilancia Sanitaria (Anvisa), el ente regulador de Brasil, aprobó hoy lunes el registro definitivo de la vacuna contra el chikungunya, producto de una investigación del estatal Instituto Butantan brasileño con el laboratorio farmacéutico franco-austríaco Valneva.
El Instituto Butantan con sede en Sao Paulo, mayor fabricante público de vacunas de América Latina, informó en un comunicado que la vacuna fue aprobada por la Anvisa luego de que fuera evaluada en Estados Unidos.
El chikungunya es una enfermedad viral que se transmite por la picadura de mosquitos Aedes aegypti infectados, los mismos que transmiten el dengue y el zika y los países más afectados son Brasil, Paraguay, Argentina y Bolivia. En Brasil se registraron 267 000 casos probables de la enfermedad y al menos 213 muertes en 2024, según el Ministerio de Salud.
«Con la opinión favorable del organismo regulador, la vacuna queda autorizada para ser aplicada en el país a la población mayor de 18 años», dice el comunicado del Instituto Butantan, entidad pública brasileña administrada por el gobierno del estado regional de Sao Paulo.
La vacuna fue evaluada en Estados Unidos en 4 000 voluntarios de entre 18 y 65 años y mostró un buen perfil de seguridad y una alta inmunogenicidad: el 98,9 % de los participantes del ensayo clínico produjo anticuerpos neutralizantes, con niveles que se mantuvieron robustos durante al menos seis meses.
Los resultados de estos ensayos habían sido publicados en la revista científica The Lancet, en junio de 2023, los cuales sirvieron para presentarles ante el ente regulador de alimentos y medicamentos del estado federal brasileño.
La vacuna contra el chikungunya ya recibió la aprobación de la Administración de Alimentos y Medicamentos (FDA), la agencia reguladora de Estados Unidos, y de la Agencia Europea de Medicamentos (EMA), de la Unión Europea.
Es la primera vacuna autorizada contra esta enfermedad, que puede provocar dolor articular crónico y que solo en 2024 afectó a 620 000 personas en todo el mundo.
A partir de ahora, la vacuna depende de la decisión de incorporarla al sistema público de salud de la Comisión Nacional de Incorporación de Tecnologías al Sistema Único de Salud (Conitec), del Ministerio de Salud.
«Una vez aprobada por Conitec, la vacuna podrá administrarse estratégicamente. En el caso del chikungunya, el plan del Ministerio podría ser vacunar primero a los residentes de las regiones endémicas, es decir, aquellas con el mayor número de casos», afirmó Esper Kallás, director del Instituto Butantan, en un comunicado.
Según la nota, la vacuna contra el chikungunya de Butantan y Valneva es un caso innovador en el mundo, ya que es la primera en ser aprobada inicialmente con base en datos de producción de anticuerpos.
14 abril 2025 | Fuente: Xinhua | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
abr
17
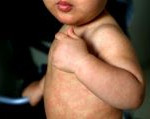 Funcionarios de salud de Texas confirmaron el martes 20 casos más de sarampión en el brote que comenzó hace casi 3 meses, junto con cinco nuevos casos en Nuevo México y seis en el centro de Ohio. La semana pasada, el número de casos de sarampión en Estados Unidos superó los 700, e Indiana se sumó a otros cinco estados con brotes activos.
Funcionarios de salud de Texas confirmaron el martes 20 casos más de sarampión en el brote que comenzó hace casi 3 meses, junto con cinco nuevos casos en Nuevo México y seis en el centro de Ohio. La semana pasada, el número de casos de sarampión en Estados Unidos superó los 700, e Indiana se sumó a otros cinco estados con brotes activos.
Aun cuando el virus continuaba propagándose y los Centros para el Control y la Prevención de Enfermedades (CDC por sus siglas en inglés) reenviaron un equipo al oeste de Texas, el secretario de Salud federal, Robert F. Kennedy Jr., afirmó en una reunión televisada del gabinete el jueves que los casos de sarampión se estaban estabilizando a nivel nacional. Estados Unidos tiene en lo que va del año más del doble de casos de sarampión que en todo 2024.
Texas reporta la mayoría de los casos de sarampión. Dos niños de edad escolar que no estaban vacunados murieron por enfermedades relacionadas con el sarampión cerca del epicentro del brote en el oeste de Texas. Un adulto en Nuevo México que no estaba vacunado también murió de enfermedad relacionada con el sarampión .
Otros estados con brotes activos —definidos como tres o más casos— son Indiana, Kansas, Oklahoma y Ohio.
El brote multiestatal confirma los temores de los expertos en salud de que el virus se afianzará en otras comunidades de Estados Unidos con bajas tasas de vacunación, y que la propagación podría extenderse durante un año. La Organización Mundial de la Salud ha dicho que hay casos en México vinculados al brote de Texas.
El sarampión es causado por un virus altamente contagioso que se transmite por el aire y se propaga fácilmente cuando una persona infectada respira, estornuda o tose. Es prevenible mediante vacunación y se había considerado eliminado de Estados Unidos desde el año 2000.
Esto es lo que hay que saber sobre el sarampión en Estados Unidos:
¿Cuántos casos de sarampión hay en Texas y Nuevo México?
El brote en Texas comenzó a finales de enero. Funcionarios de salud estatales dijeron el martes que hubo 20 nuevos casos de sarampión desde el viernes, elevando el total a 561 en 23 condados, la mayoría de ellos en el oeste del estado. Dos texanos más fueron hospitalizados, para un total de 58 durante el brote, y el condado de Reeves registró su primer caso.
Los funcionarios de salud estatales estimaron el martes que alrededor del 4% de los casos —menos de 25— son activamente infecciosos.
El 65% de los casos en Texas están en el condado de Gaines, con una población de 22 892 personas, donde el virus comenzó a propagarse en una comunidad menonita con baja tasa de vacunación. El condado ha registrado 364 casos desde finales de enero, un poco más del 1% de los residentes del condado.
La muerte del 3 de abril en Texas fue de un niño de 8 años, según Kennedy. Funcionarios de salud en Texas dijeron que el niño no tenía problemas de salud subyacentes y murió de «lo que el médico del niño describió como insuficiencia pulmonar por sarampión». Un niño no vacunado sin males subyacentes murió de sarampión en Texas a finales de febrero; Kennedy indicó que tenía 6 años.
Nuevo México anunció cinco nuevos casos el martes, elevando el total del estado a 63. Tres personas más están en el hospital, para un total de cinco desde que comenzó el brote. El condado de Doña Ana reportó su primer caso. La mayoría de los casos del estado están en el condado de Lea. Dos están en el condado de Eddy y uno en el condado de Chaves.
Los funcionarios de salud estatales dicen que los casos están vinculados al brote de Texas según pruebas genéticas. Nuevo México reportó su primera muerte relacionada con el sarampión en un adulto el 6 de marzo.
¿Cuántos casos hay en Kansas?
Kansas tiene 32 casos en ocho condados en la parte suroeste del estado, anunciaron funcionarios de salud el miércoles. Dos de los condados, Finney y Ford, son nuevos en la lista y son centros de población importantes en esa parte del estado. Haskell tiene la mayoría con ocho casos, el condado de Stevens tiene siete, el condado de Kiowa tiene seis, y el resto tiene cinco o menos.
El primer caso reportado en el estado, identificado en el condado de Stevens el 13 de marzo, está vinculado a los brotes de Texas y Nuevo México según pruebas genéticas, dijo un portavoz del departamento de salud estatal. Pero los funcionarios de salud no han determinado cómo se expuso la persona.
¿Cuántos casos hay en Oklahoma?
Los casos en Oklahoma se mantenían en 12 hasta el martes: nueve confirmados y tres probables. Los dos primeros casos probables estaban «asociados» con los brotes del oeste de Texas y Nuevo México, dijo el departamento de salud estatal.
Un portavoz del departamento de salud estatal indicó que se confirmaron exposiciones al sarampión en Oklahoma City y en los condados de Tulsa, Rogers y Custer, pero no quiso decir qué condados tenían casos.
¿Cuántos casos hay en Ohio?
El brote en el condado de Knox, en el centro-este de Ohio, ha infectado a un total de 20 personas hasta el martes, según un boletín de prensa del departamento de salud del condado, pero siete de ellas no viven en Ohio. Un brote de sarampión en el centro de Ohio enfermó a 85 personas en 2022.
El Departamento de Salud de Ohio confirmó 20 casos de sarampión en el estado la semana pasada: 11 en el condado de Ashtabula cerca de Cleveland, siete en el condado de Knox y sendos casos en los condados de Allen y Holmes. El estado actualiza su conteo los jueves, y sólo incluye a residentes de Ohio.
El brote en el condado de Ashtabula comenzó con un adulto no vacunado que había interactuado con alguien que había viajado internacionalmente.
¿Cuántos casos hay en Indiana?
Indiana confirmó seis casos conectados de sarampión en el condado de Allen, en la parte noreste del estado: cuatro son menores no vacunados y dos son adultos cuyo estado de vacunación es desconocido.
Los casos no tienen un vínculo conocido con otros brotes, dijo el miércoles el Departamento de Salud del condado Allen. El primer caso fue confirmado el lunes.
¿Dónde más está apareciendo el sarampión en EE.UU.?
También se han reportado casos de sarampión en Alaska, Arkansas, California, Colorado, Florida, Georgia, Hawai, Kentucky, Maryland, Michigan, Minnesota, Nueva Jersey, Nueva York, Pensilvania, Rhode Island, Tennessee, Vermont y Washington.
Los CDC definen un brote como tres o más casos relacionados. La agencia ha registrado siete grupos que calificaron como brotes en 2025 hasta el viernes.
En Estados Unidos, los casos y brotes generalmente se rastrean hasta alguien que contrajo la enfermedad en el extranjero. Luego puede propagarse, especialmente en comunidades con bajas tasas de vacunación. En 2019, Estados Unidos registró 1 274 casos y casi perdió su estatus de haber eliminado el sarampión. En lo que va de 2025, el conteo de los CDC es de 712.
¿Necesito un refuerzo de vacuna triple?
La mejor manera de evitar el sarampión es recibir la vacuna contra el sarampión, las paperas y la rubéola (conocida como triple o SRP*). Se recomienda la primera dosis para niños entre 12 y 15 meses de edad y la segunda entre los 4 y los 6 años.
Las personas con alto riesgo de infección que recibieron las vacunas hace muchos años pueden considerar recibir un refuerzo si viven en un área con un brote, dijo Scott Weaver, de la Red Global de Virus, una coalición internacional. Estos pueden incluir a miembros de la familia que viven con alguien que tiene sarampión o aquellos especialmente vulnerables a enfermedades respiratorias debido a condiciones médicas subyacentes.
Los adultos con «evidencia presuntiva de inmunidad» generalmente no necesitan vacunas contra el sarampión ahora, señalan los CDC. Los criterios incluyen documentación escrita de vacunación adecuada en el pasado, confirmación de laboratorio de infección pasada o haber nacido antes de 1957, cuando la mayoría de las personas probablemente se infectaron de forma natural.
Un médico puede ordenar una prueba de laboratorio para verificar los niveles de anticuerpos contra el sarampión, pero los expertos en salud no siempre recomiendan esta ruta y la cobertura del seguro de gastos médicos puede variar.
Recibir otra vacuna triple viral es inofensivo si hay preocupaciones sobre la disminución de la inmunidad, señalan los CDC.
Las personas que tienen documentación de haber recibido una vacuna viva contra el sarampión en la década de 1960 no necesitan ser revacunadas, pero las personas que fueron inmunizadas antes de 1968 con una vacuna ineficaz contra el sarampión hecha de virus «muerto» deben ser revacunadas con al menos una dosis, indica la agencia. Eso también incluye a las personas que no saben qué tipo de vacuna recibieron.
¿Cuáles son los síntomas del sarampión?
El sarampión primero infecta el tracto respiratorio, luego se propaga por todo el cuerpo y causa fiebre, secreción nasal, tos, ojos rojos y llorosos y un sarpullido.
El sarpullido generalmente aparece de tres a cinco días después de los primeros síntomas, comenzando como manchas rojas planas en la cara y luego extendiéndose hacia el cuello, tronco, brazos, piernas y pies. Cuando aparece el sarpullido, la fiebre puede aumentar a más de 40 °C (104 °F), según los CDC.
La mayoría de los niños se recuperarán del sarampión, pero la infección puede generar complicaciones peligrosas como neumonía, ceguera, inflamación cerebral y muerte.
¿Cómo se puede tratar el sarampión?
No hay un tratamiento específico para el sarampión, por lo que los médicos generalmente intentan aliviar los síntomas, prevenir complicaciones y mantener a los pacientes cómodos.
¿Por qué importan las tasas de vacunación?
En comunidades con altas tasas de vacunación —por encima del 95%—, enfermedades como el sarampión no se propagan fácilmente. Esto se llama «inmunidad de grupo».
Pero las tasas de vacunación infantil han disminuido en Estados Unidos desde la pandemia, y más personas piden exenciones religiosas o de conciencia personal para eximir a sus hijos de las vacunas requeridas.
Estados Unidos tuvo un aumento en los casos de sarampión en 2024, que incluyó un brote en Chicago que enfermó a más de 60.
*N. del E.: En Cuba se conoce esa misma vacuna como PRS.
11 abril 2025 | Fuente: AP | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia

