sep
30
 Investigadores del Instituto de Investigación Biomédica de Málaga (Ibima Plataforma Bionand) y del Hospital Virgen de la Victoria se han servido de la inteligencia artificial (IA) para identificar marcadores computacionales y avanzar en la predicción del riesgo de sangrado en pacientes con infarto de miocardio y cáncer.
Investigadores del Instituto de Investigación Biomédica de Málaga (Ibima Plataforma Bionand) y del Hospital Virgen de la Victoria se han servido de la inteligencia artificial (IA) para identificar marcadores computacionales y avanzar en la predicción del riesgo de sangrado en pacientes con infarto de miocardio y cáncer.
El estudio, que ha sido publicado en la revista European Heart Journal, marca un avance significativo en la medicina personalizada para estos pacientes, según ha informado este jueves Ibima en un comunicado.
En la investigación ha participado el cardiólogo Francesco Costa, quien lidera un proyecto centrado en la mejora de la predicción de eventos cardíacos isquémicos y de sangrado en pacientes de miocardio, sirviéndose de inteligencia artificial para la integración de datos que sirvan de biomarcadores computacionales aplicables a la práctica clínica.
Según Costa, este trabajo permite «identificar con mayor precisión a los pacientes con cáncer que tienen un alto riesgo de sangrado», algo que no solo mejora la seguridad del tratamiento sino que también facilita una atención médica más personalizada y efectiva».
Los hallazgos posibilitarán que los profesionales puedan «ajustar de manera eficiente los tratamientos antiplaquetarios, reduciendo riesgo, optimizando recursos y mejorando la calidad de vida de los pacientes con este cuadro clínico».
El estudio presenta una versión actualizada de la escala PRECISE-DAPT, una herramienta clave para evaluar el riesgo de complicaciones hemorrágicas en pacientes que reciben terapia antiplaquetaria dual.
Este es un tratamiento utilizado para prevenir la formación de coágulos sanguíneos que consiste en el uso de dos tipos de medicamentos que impiden que las plaquetas, que son las células de la sangre responsables de la coagulación, se agrupen y formen coágulos.
Es importante para personas que han tenido un ataque al corazón, un accidente cerebrovascular, o que han recibido procedimientos como la colocación de stents en las arterias. Estos medicamentos ayudan a mantener las arterias abiertas y a reducir el riesgo de futuros problemas cardíacos o circulatorios.
Aunque esta terapia es muy efectiva, también aumenta el riesgo de sangrado, por lo que los médicos deben considerar cuidadosamente los beneficios y los riesgos para cada paciente.
La investigación ha demostrado que la incorporación de datos sobre el cáncer en PRECISE-DAPT mejora la capacidad de esta herramienta para predecir riesgos de sangrado.
El estudio ha incluido a más de 216 000 pacientes con infarto de miocardio, de los cuales 4 569 tenían un diagnóstico de cáncer. Los resultados han mostrado que la nueva herramienta modificada, que incluye el cáncer como una variable binaria, mejora la precisión predictiva en comparación con la original.
En este estudio han participado otros centros de Europa como la Universidad de Keele, la Universidad de Manchester y el Hospital Universitario de Gales (Reino Unido), el Instituto Nacional de Investigación en Salud y Atención de Birmingham y la Universidad de Messina (Italia), donde Costa inició el estudio antes de su etapa en Ibima.
Además, han intervenido otros centros punteros en cardiología como el Hospital Militar de Santiago (Chile), el centro hospitalario adherido a la Universidad Médica de Harbin, junto con el laboratorio de investigación en isquemia miocárdica del Ministerio de Educación (China), así como la Unidad de Terapias Cardiovasculares Transcatéter de la Fundación de Investigación Cardiovascular de Nueva York.
26 septiembre 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
sep
11
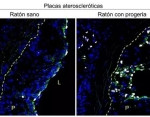 Un equipo del Centro Nacional de Investigaciones Cardiovasculares (CNIC) ha identificado un nuevo mecanismo de la aterosclerosis precoz en un síndrome de envejecimiento prematuro y han abierto así una nueva vía para buscar tratamientos eficaces para esa enfermedad . El estudio ha sido liderado por Vicente Andrés, investigador principal del Grupo de Fisiopatología Cardiovascular Molecular y Genética del CNIC y del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV), y por Magda Hamczyk, de la Universidad de Oviedo y científica visitante en el CNIC, y los resultados se publican en la revista Circulation.
Un equipo del Centro Nacional de Investigaciones Cardiovasculares (CNIC) ha identificado un nuevo mecanismo de la aterosclerosis precoz en un síndrome de envejecimiento prematuro y han abierto así una nueva vía para buscar tratamientos eficaces para esa enfermedad . El estudio ha sido liderado por Vicente Andrés, investigador principal del Grupo de Fisiopatología Cardiovascular Molecular y Genética del CNIC y del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV), y por Magda Hamczyk, de la Universidad de Oviedo y científica visitante en el CNIC, y los resultados se publican en la revista Circulation.
La aterosclerosis consiste en la acumulación anómala de células y colesterol en las paredes de las arterias, unos acúmulos, llamados placas ateroscleróticas, que llevan al endurecimiento y la obstrucción de los vasos sanguíneos, y la rotura de las placas puede provocar la formación de trombos y causar un infarto de miocardio o un ictus, lo que pone en peligro la vida de la persona afectada. Dado que los eventos cardiovasculares son la causa principal de muerte en el mundo, «las investigaciones en este campo son clave para alargar la vida de los pacientes afectados de aterosclerosis y prevenir sus complicaciones», ha señalado Vicente Andrés en una nota difundida por el CNIC.
La formación de placas ateroscleróticas progresa de forma silenciosa a lo largo de la vida y suele manifestarse clínicamente a partir de mediana edad, pero hay algunas enfermedades que cursan con aterosclerosis acelerada y que, a su vez, provocan la muerte prematura. Uno de los ejemplos más llamativos es el síndrome de Hutchinson-Gilford, también conocido como «progeria», una enfermedad genética muy rara que se manifiesta como envejecimiento durante la infancia y adolescencia, en la que la muerte precoz suele producirse a una edad promedio de 14,5 años, debido principalmente a infarto de miocardio, insuficiencia cardíaca o ictus cerebral.
Previamente el grupo de Vicente Andrés, en colaboración con el equipo liderado por Carlos López-Otín, de la Universidad de Oviedo, generó un modelo de ratón que padece los mismos síntomas que los pacientes con progeria, incluyendo la enfermedad aterosclerótica precoz.
Además, los autores demostraron que una de las causas principales de la aterosclerosis acelerada asociada a este síndrome es la muerte de las células de músculo liso vascular en la pared arterial.
El nuevo trabajo ha permitido investigar cómo las alteraciones en las células de músculo liso vascular afectan a células endoteliales, un tipo celular que separa la pared arterial de la sangre.
La investigadora Magda Hamczyk ha destacado que este estudio describe nuevos mecanismos celulares y moleculares involucrados en aterosclerosis asociada a la progeria y propone una nueva diana terapéutica para esta enfermedad.
Los investigadores han subrayado la importancia de investigar los síndromes minoritarios como la progeria, ya que pueden ayudar a buscar tratamientos para estas enfermedades «devastadoras» pero también para otros procesos patológicos, como la aterosclerosis, que afectan a la mayoría de la población y son la causa principal de muerte a nivel mundial.
09 septiembre 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
sep
4
 Una investigación apoyada por los Institutos Nacionales de Salud de Estados Unidos ha descubierto que la medición de dos tipos de grasa en el torrente sanguíneo junto con la proteína C reactiva (PCR), un marcador de inflamación, puede predecir el riesgo de enfermedad cardiovascular de una mujer décadas más tarde. Estos hallazgos, presentados como investigación de última hora en el Congreso 2024 de la Sociedad Europea de Cardiología, se publican en el New England Journal of Medicine.
Una investigación apoyada por los Institutos Nacionales de Salud de Estados Unidos ha descubierto que la medición de dos tipos de grasa en el torrente sanguíneo junto con la proteína C reactiva (PCR), un marcador de inflamación, puede predecir el riesgo de enfermedad cardiovascular de una mujer décadas más tarde. Estos hallazgos, presentados como investigación de última hora en el Congreso 2024 de la Sociedad Europea de Cardiología, se publican en el New England Journal of Medicine.
«No podemos tratar lo que no medimos y esperamos que estos hallazgos acerquen el campo a la identificación de formas aún más tempranas de detectar y prevenir las cardiopatías», afirma el Dr. Paul M. Ridker, autor del estudio y director del Centro de Prevención de Enfermedades Cardiovasculares del Hospital Brigham and Women’s de Boston.
Para el estudio, los investigadores recogieron muestras de sangre e información médica de 27 939 profesionales sanitarios residentes en Estados Unidos que participaron en el Women’s Health Study. Las mujeres, que iniciaron el estudio entre 1992 y 1995 a una edad media de 55 años, fueron objeto de seguimiento durante 30 años.
Durante este periodo, 3 662 participantes en el estudio sufrieron un infarto de miocardio, un ictus, una intervención quirúrgica para restablecer la circulación o una muerte relacionada con problemas cardiovasculares. Evaluaron el modo en que la Proteína C Reactiva (PCR) de alta sensibilidad, junto con el colesterol de lipoproteínas de baja densidad (LDL) y la lipoproteína(a), o Lp(a), un lípido formado en parte por LDL, predecían, individual y colectivamente, estos acontecimientos.
Se agrupó a las participantes en cinco categorías –desde las que tenían los niveles más altos hasta las que tenían los más bajos– para medir cada uno de los tres marcadores. Los investigadores descubrieron que las mujeres con los niveles más altos de colesterol LDL presentaban un riesgo asociado de enfermedad cardiaca un 36 % mayor que las que tenían los niveles más bajos. Las que tenían los niveles más altos de Lp(a) presentaban un riesgo asociado un 33 % mayor, y las que tenían los niveles más altos de PCR presentaban un riesgo asociado un 70 % mayor.
Cuando se evaluaron conjuntamente las tres medidas (colesterol LDL, Lp(a) y PCR), las participantes con los niveles más altos presentaban un riesgo asociado de ictus más de 1,5 veces superior y un riesgo asociado de cardiopatía coronaria más de 3 veces superior en comparación con las mujeres con los niveles más bajos.
Los investigadores señalan que, aunque sólo se evaluaron mujeres en este estudio, cabría esperar resultados similares en los hombres. «En los últimos años, hemos aprendido más sobre cómo el aumento de los niveles de inflamación puede interactuar con los lípidos para agravar los riesgos de enfermedad cardiovascular –señala Ahmed A.K. Hasan, oficial médico y director del programa en el Instituto Nacional del Corazón, los Pulmones y la Sangre (NHLBI)–. Esto ayuda a explicar por qué los niveles más bajos suelen ser mejores».
Las células inmunitarias, que ayudan al organismo a repararse de heridas o infecciones, también pueden detectar la acumulación de colesterol extra en las células o activarse en respuesta a la acumulación de placa y enviar señales inflamatorias. Esto crea un entorno hiperinflamatorio en el que la placa puede formarse, aumentar de tamaño o incluso romperse, y provocar episodios cardiovasculares.
Para mantener una salud cardiovascular óptima, los investigadores insisten en la prevención primaria. Esto incluye realizar una actividad física regular, seguir una dieta cardiosaludable, controlar el estrés y evitar el tabaco o dejar de fumar. Otras medidas para las personas con mayor riesgo pueden incluir el uso de medicación para reducir el colesterol y/o la inflamación. Los investigadores también han observado que las medidas que se toman en etapas tempranas de la vida para mejorar la salud cardiaca y vascular pueden sumarse con el tiempo y correlacionarse con mejores resultados de salud años e incluso décadas más tarde.
El colesterol LDL, que los profesionales sanitarios miden de forma rutinaria, puede tratarse con terapias ampliamente disponibles, como las estatinas. Sin embargo, las recomendaciones estándar para el cribado de la Lp(a) y la PCR pueden variar. Algunos países recomiendan el cribado de la Lp(a), ya que los niveles elevados suelen deberse a riesgos hereditarios. En zonas sin cribado universal de la Lp(a), como Estados Unidos, los médicos pueden solicitar pruebas para personas con cardiopatías o con antecedentes familiares de las mismas. Existen algunas terapias para las personas con niveles elevados y los investigadores están probando nuevos enfoques para personalizar y mejorar las opciones de tratamiento.
Las pruebas de PCR también varían. El cribado depende a menudo de los riesgos subyacentes de la persona o queda a discreción del médico. La Administración de Alimentos y Medicamentos (FDA) aprobó en 2023 la colchicina, un tratamiento antiinflamatorio utilizado anteriormente para la gota, para contrarrestar el riesgo de enfermedades cardiovasculares en personas con aterosclerosis. Se están estudiando otras terapias y enfoques antiinflamatorios.
02 septiembre 2024|Fuente: Europa Press |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
ago
29
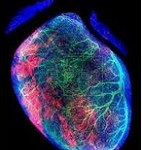 Un equipo del Instituto de Investigación Biomédica de Málaga (Ibima) y la Universidad de Málaga ha presentado un nuevo estudio científico sobre los mecanismos de formación de las arterias coronarias, con potenciales implicaciones terapéuticas para enfermedades cardíacas como el infarto de miocardio.
Un equipo del Instituto de Investigación Biomédica de Málaga (Ibima) y la Universidad de Málaga ha presentado un nuevo estudio científico sobre los mecanismos de formación de las arterias coronarias, con potenciales implicaciones terapéuticas para enfermedades cardíacas como el infarto de miocardio.
La investigación se centra en comprender cómo las células endoteliales del corazón se organizan y especializan para formar una red vascular funcional, ha informado este martes el Ibima en un comunicado.
Utilizando técnicas avanzadas de transcriptómica de una sola célula y de trazado de linaje, el equipo ha identificado una población de células especializadas, conocidas como ‘células prearteriales’, que juegan un papel crucial en la formación de arterias coronarias desde el desarrollo embrionario hasta la adultez.
Las células prearteriales son células altamente migratorias y poseen un metabolismo muy activo que, durante el proceso de remodelado de la red vascular del corazón, dan lugar a las arterias coronarias.
Este nuevo estudio revela que la especificación de las células prearteriales ocurre durante el llamado proceso de angiogénesis, muy tempranamente en el embrión.
En el proceso de angiogénesis, que es la formación de nuevos vasos sanguíneos a partir de otros ya preexistentes, participan unas células que se sitúan en el frente del nuevo vaso, conocidas como células punta, y que guían la dirección del crecimiento vascular.
Este trabajo ha descubierto que las células forman las arterias coronarias fueron previamente células punta, lo que demuestra que la posición de la célula endotelial al frente del crecimiento de un vaso determina su destino posterior.
La investigación ha revelado que las células prearteriales no solo contribuyen a la formación de arterias durante el desarrollo, sino que también se reactivan en respuesta a lesiones cardíacas, lo que podría abrir nuevas vías para tratamientos regenerativos en pacientes con enfermedades cardíacas.
La investigadora que ha liderado el estudio, Elena Cano, ha explicado que «la comprensión de cómo se forman y organizan las arterias coronarias es fundamental para desarrollar nuevas estrategias terapéuticas que puedan restaurar el flujo sanguíneo en corazones dañados por un infarto».
También ha destacado que «los resultados de este estudio sugieren que las células prearteriales tienen un papel conservado a lo largo de la vida y que su activación puede ser clave en la respuesta del corazón a lesiones isquémicas».
Cano ha apuntado que este trabajo «permite avanzar en el entendimiento de las enfermedades cardiovasculares y en el desarrollo de terapias más efectivas».
El equipo investigador ha precisado que estos mecanismos no solo tienen implicaciones para el tratamiento de enfermedades cardíacas, sino que también proporcionan una base sólida para futuros estudios en esta línea de investigación integrada en terapia regenerativa y angiogénesis.
27 agosto 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
ago
2
 La incidencia de infartos de miocardio y de accidentes cerebrovasculares disminuyó tras la vacunación contra el covid-19, según un estudio con datos de 46 millones de personas adultas que hoy se publica en la revista Nature Communications.
La incidencia de infartos de miocardio y de accidentes cerebrovasculares disminuyó tras la vacunación contra el covid-19, según un estudio con datos de 46 millones de personas adultas que hoy se publica en la revista Nature Communications.
En el trabajo se han estudiado los datos de prácticamente toda la población adulta de Inglaterra, y la conclusión principal es que la incidencia de infartos de miocardio y de accidentes cerebrovasculares fue menor tras comenzar la campaña de vacunación que antes o en comparación con las personas que estaban sin vacunar.
La investigación ha sido liderada por las universidades de Cambridge, Bristol y Edimburgo y facilitada por el Centro de Ciencia de Datos de la Fundación Británica del Corazón (BHF), que analizó registros de salud no identificados de 46 millones de adultos en Inglaterra entre el 8 de diciembre de 2020 y el 23 de enero de 2022.
El estudio demostró que la incidencia de trombosis arteriales, como infartos de miocardio y accidentes cerebrovasculares, era hasta un 10 % en las 13 a 24 semanas posteriores a la primera dosis de la vacuna contra el covid-19.
Tras una segunda dosis, la incidencia fue hasta un 27 % menor después de recibir la vacuna de AstraZeneca y hasta un 20 % menor después de la vacuna de Pfizer/Biotech, ha concluido el trabajo, que apunta además que la incidencia de episodios trombóticos venosos comunes -principalmente embolia pulmonar y trombosis venosa profunda de las extremidades inferiores- siguió un patrón similar.
La investigación respalda aún más el amplio conjunto de pruebas sobre la eficacia del programa de vacunación contra el covid, que ha demostrado proporcionar protección contra la enfermedad grave y ha salvado millones de vidas en todo el mundo, han valorado los investigadores.
Algunas investigaciones anteriores ya habían descubierto que la incidencia de complicaciones cardiovasculares raras es mayor después de algunas vacunas contra el covid-19, ya que se han notificado incidencias de miocarditis y pericarditis tras vacunas basadas en ARNm, como la de Pfizer/Biotech, y trombocitopenia trombótica inducida por vacunas basadas en adenovirus, como la de AstraZeneca.
El estudio que se publica hoy respalda esos hallazgos, pero lo más importante es que no identificó nuevas afecciones cardiovasculares adversas asociadas a la vacunación y ofrece más garantías de que los beneficios de la vacunación superan a los riesgos.
La incidencia de enfermedades cardiovasculares es mayor después de sufrir la enfermedad, especialmente en los casos graves, lo que puede explicar por qué la incidencia de infartos de miocardio y accidentes cerebrovasculares es menor en las personas vacunadas en comparación con las no vacunadas.
El equipo de investigación utilizó datos vinculados no identificados de consultas médicas, ingresos hospitalarios y registros de defunciones, que se analizaron en un entorno de datos seguro, han subrayado los autores del estudio.
31 julio 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2024. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
mar
2
 Descubren que un metabolito microbiano intestinal induce hiperreactividad plaquetaria conduciendo así a la formación de trombosis en covid-19.
Descubren que un metabolito microbiano intestinal induce hiperreactividad plaquetaria conduciendo así a la formación de trombosis en covid-19.
Desde el inicio de la pandemia por covid-19, la comunidad científica observó una relación entre el desarrollo de trombosis -principal causa de muerte y discapacidad después sufrir eventos cardiovasculares graves como infarto de miocardio, accidente cerebrovascular isquémico y embolia pulmonar-, y la infección originada por el virus SARS-CoV-2; una asociación que en los últimos años ha sido objeto de numerosas investigaciones.
El descubrimiento, publicado en la revista Cell Metabolism y llevada a cabo por investigadores de la Universidad de Guangdong, en China. Uno de los mecanismos de la propensión a la trombosis en covid-19. Este se originaría a través de un metabolito bacteriano del microbioma intestinal, denominado 2-metilbutirilcarnitina (2MBC) que al acumularse induce hiperreactividad plaquetaria y formación de trombos.
Como conclusiones, el equipo, dirigido por Kang Huang, del Centro de Innovación Traslacional de Inmunología de Precisión de Nanhai, de la Universidad de Guangdong, China, señala que 2MBC es un cometabolito que une la disbiosis y la trombosis de la microbiota intestinal. «La acumulación de 2MBC conduce a un mayor riesgo trombótico. 2MBC se une directamente a la integrina α2β1 y potencia la hiperreactividad plaquetaria, por lo que la inhibición de la integrina α2β1 mejoraría el mayor riesgo trombótico inducido por 2MBC».
Hiperreactividad plaquetaria, en el centro de la acción
La hiperreactividad plaquetaria es uno de los factores más importantes que contribuyen a la formación de trombos y a la isquemia diseminada. La evidencia acumulada de datos de numerosos trabajos ha documentado una respuesta funcional hiperreactiva en las plaquetas en numerosas patologías como diabetes, obesidad, hiperlipidemia, hipertensión o infección viral.
Otro ejemplo claro ha sido la covid-19, enfermedad que ha producido un fuerte aumento de los eventos trombóticos. «En particular, la hiperreactividad de las plaquetas y su carga trombótica aumentada asociada no sólo estuvieron presentes durante la fase aguda de la infección, sino que también permanecieron en los pacientes incluso después de la eliminación del virus, destacando que las vías no clásicas y no reveladas, que son distintas del ataque viral o reacción inflamatoria aguda, podrían estar implicadas en la regulación de la actividad plaquetaria. Así, los estudios en pacientes con coviv-19 parecen útiles para identificar nuevos mecanismos que contribuyen a la trombosis».
La investigación partió del hecho de que los mecanismos subyacentes siguen siendo poco conocidos, pero el estudio indica que la 2-metilbutirilcarnitina (2MBC), una acilcarnitina de cadena ramificada, se acumula en pacientes con covid-19 y en pacientes con eventos cardiovasculares graves. «2MBC mejora la hiperreactividad plaquetaria y la formación de trombos en ratones. Mecánicamente, 2MBC se une a la integrina α2β1 en las plaquetas, potenciando la activación de la fosfolipasa A2 citosólica (cPLA2) y la hiperreactividad plaquetaria».
En el trabajo, el equipo también sugiere que el agotamiento genético o la inhibición farmacológica de la integrina α2β1 revierte, en gran medida, los efectos protrombóticos de 2MBC. «En particular, 2MBC se puede generar de una manera dependiente del microbiota intestinal, mientras que la acumulación de 2MBC en plasma y su efecto agravante de la trombosis mejoran en gran medida después del agotamiento microbiano inducido por antibióticos», explica Sifan Chen, investigador de la citada universidad y firmante del trabajo.
Dado que la alteración del microbiota intestinal puede contribuir a las complicaciones agudas y a largo plazo de la covid-19, los investigadores plantearon la hipótesis de que el microbiota intestinal puede afectar el riesgo trombótico en la infección por coronavirus del síndrome respiratorio agudo grave (SARS-CoV-2).
Para probar esto, se pretrató a ratones transgénicos ACE2 (hACE2) humanizados (con reemplazo de ACE2 endógeno de ratón) con un cóctel de antibióticos, ofreciendo los resultados que se detallan en el trabajo. «Nuestro estudio implica al 2MBC como un metabolito que vincula la disbiosis de la microbiota intestinal con un riesgo trombótico elevado, proporcionando información mecanicista y una posible estrategia terapéutica para la trombosis», concluye Huang.
Ver artículo: Huang K, Li Z, He X, Dai J, Huang B, Shi Y, et al. Gut microbial co-metabolite 2-methylbutyrylcarnitine exacerbates thrombosis via binding to and activating integrin α2β1. Cell Metabolism[Internet].2024[citado 1 mar 2024]. https://doi.org/10.1016/j.cmet.2024.01.014
01 marzo 2024| Fuente: Diario Médico| Tomado de | Especialidades| Microbiología y Enfermedades Infecciosas

