ene
27
 Una investigación de la Universidad de Extremadura (UEx) y el Hospital San Pedro de Alcántara en Cáceres propone un nuevo biomarcador para la prevención y tratamiento del ictus, la proteína STC2, tras revelar que niveles bajos de la misma se asocian a un mayor riesgo de accidente cerebrovascular.
Una investigación de la Universidad de Extremadura (UEx) y el Hospital San Pedro de Alcántara en Cáceres propone un nuevo biomarcador para la prevención y tratamiento del ictus, la proteína STC2, tras revelar que niveles bajos de la misma se asocian a un mayor riesgo de accidente cerebrovascular.
El estudio es fruto de la colaboración entre el departamento de Fisiología de la Facultad de Veterinaria de la UEx y el servicio de Hematología del citado hospital del Servicio Extremeño de Salud (SES).
Plantea que la proteína STC2 desempeña un papel esencial en la regulación de la actividad plaquetaria y, por tanto, en la formación de trombos arteriales.
El hallazgo ha sido publicado recientemente en la revista Journal of Molecular Sciences.
Este abre la puerta a nuevas estrategias para prevenir el ictus, una de las principales causas de muerte y discapacidad en el mundo.
Regulación de la actividad plaquetaria
STC2 es una proteína que participa en la regulación de la entrada del ion calcio en varios tipos de células.
Entre ellas las plaquetas humanas y de ratón, impidiendo el exceso de calcio en la célula.
Cuando la STC2 disminuye, aumenta la entrada de calcio en las plaquetas favoreciendo su agregación y la consiguiente formación de trombos, especialmente en las arterias.
Esto es lo que ocurre en los pacientes diagnosticados de ictus, un tipo de trombosis arterial que afecta a la circulación cerebral.
La investigación sobre el papel de la STC2 aporta un enfoque diferente en el estudio de los mecanismos que contribuyen a la trombosis, centrado en la hiperagregabilidad plaquetaria relacionada con la entrada de calcio en las plaquetas.
La hematóloga Nuria Bermejo, primera autora del estudio, recuerda que la trombosis es una patología multifactorial.
En cada paciente puede pesar más un tipo u otro de causas que la favorezcan. Por ello, añade, «cuanto más amplio sea el panel de factores que caractericemos e identifiquemos, más oportunidades tendremos de prevenir y tratar esta patología».
Trombosis arterial
En la primera de las dos fases de investigación, se realizó un estudio prospectivo no aleatorizado de una cohorte de pacientes de dicho hospital. En concreto, se llevó a cabo el correspondiente estudio de trombofilia, que es una tendencia anormal a desarrollar trombos, tras un episodio de trombosis, venosa o arterial.
Por su parte, el equipo de Pedro Cosme en el Departamento de Fisiología de la UEx, analizó las muestras de sangre de los pacientes.
Los primeros resultados confirmaron la causalidad entre la alteración de expresión de la proteína STC2 y el aumento de la entrada de calcio, tal y como, se había previamente descrito en plaquetas de ratón.
Los investigadores hallaron, por tanto, una relación entre los niveles de STC2 y el riesgo de presentar trombosis arterial.
En una segunda fase posterior, el equipo realizó un seguimiento de los pacientes participantes en el estudio durante más de 10 años.
Se revisaron las historias de los pacientes diagnosticados de ictus y trombosis arterial, y se midieron los parámetros bioquímicos en la UEx.
«Los resultados indicaron valores de STC2 en su mayoría normalizados con respecto a los pacientes sanos gracias al tratamiento con aspirina que regula los niveles de STC2», explica la doctora Bermejo.
Tratamiento preventivo
Tras este primer hallazgo relevante sobre el papel de STC2 en trombosis, se prevé realizar estudios multicéntricos aleatorizados con mayor número de pacientes.
Se incluirán además otras patologías trombóticas como los síndromes coronarios agudos (infarto de miocardio) o crónicos que avalen la proteína STC2 como biomarcador de ictus.
Los investigadores subrayan que el seguimiento regular de la proteína STC2 es un buen candidato de biomarcador de ictus en colectivos ya en riesgo y en la población general, que por edad tiene un mayor riesgo de sufrir trombosis, favoreciendo así el tratamiento preventivo con aspirina.
Además, la detección periódica de STC2 podría ayudar a valorar en qué pacientes el tratamiento con aspirina es efectivo para prevenir el desarrollo de nuevos ictus, concluye el comunicado.
22 enero 2026 | Fuente: EFE | Tomado de | Noticia
sep
17
 La investigación, que se ha publicado en la revista Nature Genetics, liderada por Geoff Macintyre, jefe del Grupo de Oncología Computacional del Centro Nacional de Investigaciones Oncológicas (CNIO), en colaboración con la Universidad de Cambridge y la empresa ‘spin off’ Tailor Bio, ha desarrollado un método que predice en qué pacientes no serán eficaces los tratamientos estándar con quimioterapias de uso frecuente, basados en los compuestos con platino, taxanos y antraciclinas.
La investigación, que se ha publicado en la revista Nature Genetics, liderada por Geoff Macintyre, jefe del Grupo de Oncología Computacional del Centro Nacional de Investigaciones Oncológicas (CNIO), en colaboración con la Universidad de Cambridge y la empresa ‘spin off’ Tailor Bio, ha desarrollado un método que predice en qué pacientes no serán eficaces los tratamientos estándar con quimioterapias de uso frecuente, basados en los compuestos con platino, taxanos y antraciclinas.
«Hemos hallado la manera de hacer medicina de precisión con quimioterapias estándar», afirma Macintyre, quien ha realizado el trabajo con los investigadores Joe Sneath Thompson y Bárbara Hernando, del CNIO, y Laura Madrid, de Tailor Bio como primeros autores.
La quimioterapia busca acabar con las células tumorales mediante fármacos, y es desde hace décadas un tratamiento habitual contra el cáncer. Sin embargo, no siempre da buen resultado. «Las quimioterapias son buenas para algunos pacientes, pero no son efectivas en todos los casos. Entre un 20% y un 50% de los enfermos de cáncer no responden a estos fármacos», afirma Macintyre, quien recuerda que «estos pacientes sufrirán efectos secundarios causados por la quimioterapia, sin ningún beneficio clínico».
«Es importante destacar que nuestro estudio introduce biomarcadores que permiten la estratificación de pacientes cuando se emplean múltiples quimioterapias no desarrolladas originalmente como terapias dirigidas», escriben los investigadores.
«Hemos desarrollado un test genómico que permite que tres quimioterapias estándar se usen de forma dirigida, es decir, en pacientes que sabemos que pueden responder a ellas», explica Thompson. «Este test puede aplicarse a diferentes tipos de cáncer; nuestros resultados pueden beneficiar a unos cientos de miles de pacientes al año», añade.
ENSAYO PARA LLEVAR ESTA TECNOLOGÍA A LA CLÍNICA
Una vez desarrollados los biomarcadores, el equipo del CNIO puso a prueba sus biomarcadores de manera innovadora: con un ensayo emulado, es decir, con datos ya existentes. Los autores recurrieron a gran cantidad de datos procedentes de pacientes con cáncer que ya habían sido tratados con las quimioterapias analizadas en el estudio.
En concreto, el grupo trabajó con datos de 840 pacientes con diferentes tipos de cáncer. «Hemos utilizado datos de pacientes con cáncer de mama, próstata, ovario y sarcoma», indica Hernando. Así han logrado demostrar la eficacia de los biomarcadores de resistencia que proponen ante alguno de los tres tipos de quimioterapia evaluados -basadas en los compuestos platino, taxanos y antraciclinas-.
Para llevar este conocimiento a la clínica, la tecnología desarrollada por los investigadores del CNIO debe ser ahora validada en un entorno hospitalario. El grupo ya ha recibido para ello financiación del Ministerio para la Transformación Digital y de la Función Pública.
Este proyecto, en colaboración con la empresa ‘spin off’ Tailor Bio y el Hospital Universitario 12 de Octubre (H12O), evaluará la integración de la tecnología en el sistema sanitario analizando muestras ya disponibles de pacientes. Esto demostrará que la tecnología está lista para utilizarse en ensayos clínicos en 2026.
«Llevar un biomarcador de la fase de descubrimiento a la clínica no suele ser sencillo. Pero con persistencia y colaboración es posible convertir un proyecto de investigación en una tecnología realmente prometedora desde el punto de vista clínico», dice Macintyre.
RECONOCER CADA TUMOR POR LAS ALTERACIONES EN LOS CROMOSOMAS
El método desarrollado por el equipo del CNIO se basa en el hecho de que muchos tumores acumulan alteraciones o cambios en el número de cromosomas de sus células. Una consecuencia, explica Laura Madrid, es que «las células cancerosas no tienen la cantidad de material genético adecuado».
«Llevar un biomarcador de la fase de descubrimiento a la clínica no suele ser sencillo. Pero con persistencia y colaboración es posible convertir un proyecto de investigación en una tecnología realmente prometedora desde el punto de vista clínico», dice Macintyre.
El uso preciso de la quimioterapia beneficia no solo a los pacientes, sino al sistema en su conjunto: al reducirse el gasto en terapias ineficaces, y en tratar complicaciones relacionadas con los efectos secundarios de la terapia, disminuye el gasto sanitario.
23 junio 2025 | Fuente: Europa Press | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
sep
15
 El análisis proteómico mediante inteligencia artificial se perfila como herramienta diagnóstica y de monitorización en la fase de pródromo de la enfermedad.
El análisis proteómico mediante inteligencia artificial se perfila como herramienta diagnóstica y de monitorización en la fase de pródromo de la enfermedad.
Un equipo internacional de investigadores ha identificado 17 proteínas circulantes que, junto a variables demográficas, distinguen a los pacientes con esclerosis lateral amiotrófica (ELA) de los individuos sanos. Mediante la aplicación de inteligencia artificial, los científicos han demostrado que estas proteínas pueden ser utilizadas con propósito diagnóstico, ofreciendo una fiabilidad del hasta el 96 %.
Ésta se mantuvo elevada incluso después de excluir la contribución del biomarcador NEFL, considerado clínicamente relevante en esta patología. El potencial de estas proteínas fue puesto de manifiesto en un análisis adicional, que identificó un subconjunto de 8 componentes que distinguen a los pacientes que presentan expansiones en la región C9orf72 de los que no presentan esta anomalía genómica.
Los niveles de otras 6 proteínas se encontraron elevados en pacientes sintomáticos C9orf72+, lo que indica que pueden ser utilizadas como biomarcadores de fenoconversión.
Así lo afirma Bryan Traynor, investigador de los Institutos Nacionales de la Salud de los EE.UU. y director del estudio, quien prosigue indicando que las proteínas identificadas están asociadas a procesos biológicos relativos al desarrollo y degeneración del músculo esquelético, al metabolismo energético y a la excitotoxicidad mediada por el neurotransmisor NMDA, corroborando observaciones previas.
Notablemente, las alteraciones en los biomarcadores circulantes seleccionados no mostraron ningún vínculo con las variaciones de los correspondientes genes, asegura el científico. Traynor concluye indicando que la implementación de estas proteínas en un modelo de Machine Learning ha posibilitado la generación de un índice cuyo progresivo aumento se asocia a mayor riesgo de aparición de los síntomas, en pacientes que todavía no los presentan.
Los resultados fueron publicados en la revista Nature Medicine.
12 septiembre 2025 | Fuente: IM Médico | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
sep
2
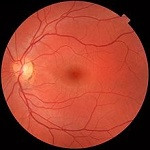 Un reciente estudio apunta que el grosor de la retina puede revelar la susceptibilidad de sufrir este trastorno mental. Este hallazgo puede ser muy útil en materia de prevención y a la hora de diseñar tratamientos personalizados, pero cuando se trata de salud mental no se puede perder de vista el enfoque bio-psico-social.
Un reciente estudio apunta que el grosor de la retina puede revelar la susceptibilidad de sufrir este trastorno mental. Este hallazgo puede ser muy útil en materia de prevención y a la hora de diseñar tratamientos personalizados, pero cuando se trata de salud mental no se puede perder de vista el enfoque bio-psico-social.
El grosor de la retina puede revelar la susceptibilidad de sufrir esquizofrenia, un trastorno mental grave e incapacitante que en España padecen alrededor de medio millón de personas.
Así lo señala un reciente estudio publicado en Nature Mental Health en el que la Universidad de Zúrich y el Hospital Universitario de Psiquiatría de Zúrich recopilaron información de cerca de 35.000 individuos de la base de datos del UK Biobank.
Elena López Terrones, doctora en Biomedicina y profesora en la Universidad Europea de Valencia, especializada en neurociencia, psicofarmacología y trastornos mentales graves, profundiza en las conclusiones más destacadas de la investigación.
«Las personas con mayor riesgo genético de desarrollar esquizofrenia presentan un adelgazamiento específico de ciertas capas de la retina. Lo más impactante es que esto sucede incluso antes de manifestar síntomas clínicos», señala. En este sentido, explica que las capas más afectadas fueron la mácula y la capa de células ganglionares internas.
«Los axones de estas células ganglionares se juntan formando el nervio óptico, el cual conecta directamente con el cerebro, de ahí que digamos que la retina es una `ventana al cerebro’. Se comprobó que este adelgazamiento no era debido a enfermedades oculares, sino que correlacionaba de manera directa con el riesgo genético de cada persona a sufrir esquizofrenia (a mayor riesgo, más fina la retina)», apunta la doctora.
Y agrega que esta asociación fue particularmente fuerte cuando se centraron en genes relacionados con vías neuroinflamatorias, «lo que sugiere que la inflamación cerebral crónica podría estar detrás de estos cambios». Además, «las personas con mayor riesgo genético también mostraban mayores niveles de proteína C reactiva (CRP), un marcador de inflamación». Por lo tanto, el adelgazamiento de la retina podría ser un biomarcador temprano y no invasivo del riesgo de desarrollar esquizofrenia.
Los resultados se basan en el análisis de datos de casi 35.000 personas. Sobre esta metodología, la doctora apunta que «utilizaron puntuaciones de riesgo poligénico (PRS) para determinar la predisposición genética de cada una a desarrollar esquizofrenia y midieron el grosor de la retina utilizando la tomografía de coherencia óptica (OCT), una técnica totalmente indolora y bastante rápida».
Lo novedoso de la investigación
En palabras de López Terrones, «aunque ya existían estudios que relacionaban la esquizofrenia con el adelgazamiento de la retina, lo novedoso de esta investigación es que analiza datos de personas sin diagnóstico ni síntomas, dando un paso más allá hacia un enfoque preventivo y de detección precoz».
Como menciona, la variable genética juega un papel clave en el grosor de la retina, y al parecer, mediado por procesos inflamatorios. «El estudio encontró que ciertas combinaciones genéticas relacionadas con la neuroinflamación se asocian a una retina más delgada». La neuroinflamación es, en pocas palabras, una especie de «alarma interna» del cerebro que nos dice que algo no va bien. «Sería similar a la fiebre con la que nuestro cuerpo reacciona cuando tenemos una infección o la hinchazón cuando nos damos un golpe. El cerebro tiene sus propias defensas que van a responder cuando las cosas no van como deberían. Esta respuesta inflamatoria está mediada por células del propio sistema nervioso que al activarse liberarán sustancias para intentar proteger el tejido cerebral».
¿Y qué puede activar esa alarma? «Muchas cosas», apunta, y añade: «Desde infecciones (virales o bacterianas), hasta el estrés crónico, alteraciones inmunológicas o, incluso, predisposición genética». En el caso de enfermedades mentales como la esquizofrenia, «se ha observado que este tipo de inflamación puede estar presente de forma persistente, afectando el funcionamiento normal de las neuronas y otras estructuras del cerebro, incluida la retina. Es como si el cerebro viviera en un estado de alerta constante, lo que, a largo plazo, puede provocar cambios sutiles pero importantes en su estructura y función», prosigue.
Al respecto, la OCT, un escáner ocular usado habitualmente por oftalmólogos, es el método de detectar los cambios en la retina que pueden dar la voz de alarma. «Es muy rápido y en tan solo segundos, genera imágenes de alta resolución del interior del ojo», explica y recalca que es no invasivo e indoloro.
`Cautela y perspectiva’ para abordar estos avances
Con lo cual, este hallazgo puede suponer que, «con una prueba sencilla, rápida, no invasiva y mucho más económica que cualquier técnica de neuroimagen, fuera posible detectar el riesgo de desarrollar esquizofrenia». Pero no solo eso: en personas que ya presentan síntomas, también podría ayudar a prever cómo evolucionará la enfermedad.
«Este avance puede ser clave en el terreno de la prevención. Si una persona muestra un alto riesgo genético, podría beneficiarse de psicoeducación específica, que le ayude a reconocer señales tempranas y acudir antes a un especialista. Sabemos que cuanto antes se inicia el tratamiento, mejor pronóstico hay: uno de los factores de mal pronóstico es haber pasado demasiado tiempo con síntomas sin recibir ayuda», sostiene López Terrones.
Para mayor información, leer el PDF adjunto.
20 agosto 2025 | Fuente: IM Médico | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
may
6
 Un equipo del Instituto de Investigación Biomédica de Málaga (Ibima) ha llevado a cabo un estudio pionero que demuestra la necesidad de personalizar la composición de la nutrición para aquellos pacientes con diabetes que requieren alimentarse por vía venosa, es decir, que reciben alimentación parenteral.
Un equipo del Instituto de Investigación Biomédica de Málaga (Ibima) ha llevado a cabo un estudio pionero que demuestra la necesidad de personalizar la composición de la nutrición para aquellos pacientes con diabetes que requieren alimentarse por vía venosa, es decir, que reciben alimentación parenteral.
La diabetes mellitus afecta a más de 537 millones de personas en el mundo, y muchas de ellas, que han pasado por procesos de cirugía mayor se encuentran en tratamiento contra el cáncer o sufren enfermedades intestinales graves o infecciones severas, tienen un sistema digestivo que no puede procesar los alimentos correctamente, por lo que requieren alimentarse administrando los nutrientes directamente al torrente sanguíneo.
Los resultados de este estudio, publicados en la revista científica Clinical Nutrition, aportan evidencias sobre el impacto de las distintas formulaciones de nutrición parenteral en la inflamación y la función intestinal de los pacientes, ha informado este miércoles el Ibima en un comunicado.
Dado que no todas las formulaciones tienen el mismo impacto en el organismo, algunas pueden influir negativamente en el equilibrio inflamatorio y oxidativo, incrementando el riesgo de complicaciones metabólicas, mientras que otras tienen perfiles más favorables.
Sin embargo, hasta ahora no se habían investigado en profundidad estos efectos en personas con diabetes, un grupo especialmente sensible a estos desequilibrios.
«Este estudio nos permite comprender mejor cómo las diferentes fórmulas de nutrición parenteral afectan a las personas con diabetes, y la importancia de ajustar su composición para minimizar riesgos metabólicos», ha explicado Gabriel Olveira, coordinador del grupo Endocrinología y Nutrición, Diabetes y Obesidad, de Ibima.
Ha añadido que «los resultados refuerzan la necesidad de una monitorización más precisa y estrategias nutricionales personalizadas para mejorar la seguridad y eficacia de esta terapia en un grupo especialmente vulnerable».
El estudio, realizado en varios hospitales españoles, analizó a personas con diabetes mellitus sometidas a diferentes formulaciones de nutrición parenteral, observando la evolución de distintos biomarcadores en su sangre.
Así, se observó que algunas fórmulas pueden favorecer la producción de moléculas asociadas a estrés oxidativo, susceptibles de ocasionar daños en las células y los tejidos, mientras que otras presentan un perfil más favorable.
Además, identificaron diferencias en cuanto a la permeabilidad intestinal, es decir, a la capacidad de las membranas intestinales para permitir el paso de los nutrientes, demostrándose que las fórmulas enriquecidas con ácidos grasos omega-3, seguidas de las basadas en aceite de oliva, son las que presentan una mejor evolución.
Estos resultados confirman la necesidad de un abordaje más personalizado en la administración de la nutrición parenteral en personas con diabetes, ajustando la composición de nutrientes y monitorizando los efectos a nivel metabólico.
Los investigadores han destacado que este estudio podría servir de base para mejorar los protocolos clínicos en personas con diabetes que requieren nutrición parenteral y que optimizar la composición de esta terapia podría reducir riesgos y mejorar la calidad de vida de estas personas.
«Estos resultados refuerzan la importancia de adaptar la nutrición parenteral a las necesidades específicas de las personas con diabetes. Con una monitorización adecuada y estrategias nutricionales optimizadas, podemos minimizar los efectos negativos y mejorar los resultados clínicos», ha señalado el equipo investigador.
El estudio abre nuevas líneas de investigación sobre cómo formular la nutrición parenteral para minimizar la inflamación y el estrés oxidativo, mediante la utilización de formulaciones que ofrezcan una combinación de nutrientes que permita reducir los efectos negativos observados con algunos tipos de nutrición parenteral.
30 abril 2025 | Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
may
5
 Una nueva prueba alternativa detecta de forma precoz la posible acumulación de grasa en el torrente sanguíneo, mediante la medición de los niveles de apolipoproteínas B (apoB), demuestra un estudio publicado hoy en European Heart Journal. En poblaciones adultas generalmente sanas, los niveles de apoB superiores a 100 mg/ dL se asocian a un aumento sustancial de eventos cardiogénicos, explicó el principal autor de este estudio e investigador de la Universidad Tecnológica de Chalmer (Suecia), Jakub Morze.
Una nueva prueba alternativa detecta de forma precoz la posible acumulación de grasa en el torrente sanguíneo, mediante la medición de los niveles de apolipoproteínas B (apoB), demuestra un estudio publicado hoy en European Heart Journal. En poblaciones adultas generalmente sanas, los niveles de apoB superiores a 100 mg/ dL se asocian a un aumento sustancial de eventos cardiogénicos, explicó el principal autor de este estudio e investigador de la Universidad Tecnológica de Chalmer (Suecia), Jakub Morze.
Al evaluar la posible existencia de una enfermedad cardiaca, los médicos miden la cantidad de colesterol LDL —el perjudicial — a través de un análisis de laboratorio.
Sin embargo, dado que el colesterol no puede circular ni causar daños sin sus lipoproteínas transportadoras, el equipo de Morze se dedicó a evaluar la cantidad de apolipoproteínas B como un indicador más preciso de riesgo coronario.
La apoB integra la información procedente, tanto del colesterol LDL como de los triglicéridos, al medir directamente el número de partículas aterogénicas circulantes, explicó Morze.
Esto quiere decir que cuando se analiza esta molécula se puede saber qué partículas de grasa pueden tapar las arterias sin necesidad de saber su cantidad.
De hecho, hasta ahora no estaba claro si dos pacientes con el mismo nivel del llamado «colesterol malo» presentaban el mismo riesgo de enfermedad cardiaca. Era necesario especificar el tipo de lipoproteína transportadora, así como su tamaño y cantidad en sangre.
Para llevar a cabo las investigaciones, los científicos analizaron muestras de sangre de más de 200 000 personas del Biobanco del Reino Unido sin antecedentes de cardiopatía.
Se centraron específicamente en las lipoproteínas que transportaban apoB y realizaron un seguimiento a los pacientes durante 15 años para ver qué tipo de proteínas estaban más relacionadas con ataques cardiacos. Descubrieron que la apoB es el mejor marcador para evaluar el riesgo de enfermedad coronaria, dado que indica el número total de partículas de colesterol LDL y ofrece mayor precisión que las mediciones estándar.
La detección temprana es relevante porque entre el 20 y el 40% de los casos iniciales de enfermedad coronaria son mortales, explican.
Esto no significa que las pruebas convencionales no sean eficaces, pero, en aproximadamente uno de cada 12 pacientes, pueden subestimar el riesgo de posibles eventos relacionados con el corazón, destaca el estudio.
29 abril 2025 | Fuente: Prensa Latina | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia

