ago
24
Un reciente estudio revela el mecanismo por el que una mutación en el gen ACTA2 predispone al desarrollo temprano de enfermedad coronaria en ausencia de factores de riesgo cardiovascular como los niveles elevados de colesterol en sangre.
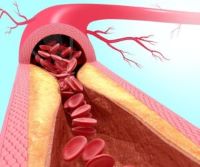 Una mutación en el gen ACTA2 deriva en la formación de placas ateroscleróticas en la aorta y mayor riesgo de enfermedad coronaria, independientemente de los niveles de colesterol y otras grasas. Un reciente estudio revela por qué.
Una mutación en el gen ACTA2 deriva en la formación de placas ateroscleróticas en la aorta y mayor riesgo de enfermedad coronaria, independientemente de los niveles de colesterol y otras grasas. Un reciente estudio revela por qué.
Desde su identificación en 2009, la mutación p.Arg149Cys del gen ACTA2 ha planteado un enigma para los investigadores. Como otras mutaciones en el gen ACTA2, p.Arg149Cys predispone al desarrollo de enfermedad torácica aórtica. Además, esta mutación aumenta el riesgo a desarrollar enfermedad coronaria de forma prematura (a los 30 años o antes) en personas que no presentan factores de riesgo cardiovascular.
“El gen ACTA2 codifica una proteína específica que no tiene nada que ver con el colesterol”, ha señalado Dianna Milewicz, profesora y directora de la División de Genética Médica en la Escuela de Medicina McGovern en UTHealth Houston. “Fue una sorpresa descubrir que las personas con la mutación genética tenían demasiada aterosclerosis a una edad temprana y sin factores de riesgo.”
Recientemente, a partir de diferentes estudios en ratón, el equipo de Milewicz ha identificado cómo se produce el efecto patogénico de p.Arg149Cys, mecanismo que tiene repercusiones clínicas para el tratamiento de algunos pacientes con enfermedad cardiovascular. Los resultados se han publicado en la revista European Heart Journall.
De la mutación al mecanismo de patogenicidad
ACTA2 codifica para SMA, una proteína del citoesqueleto de las células musculares que recubren los vasos sanguíneos. Como elemento estructural necesario para la contracción de estas células, su conexión con la aterosclerosis que provoca la enfermedad coronaria no estaba clara en un principio.
Para resolver el papel de la mutación p.Arg149Cys en la aterosclerosis, en primer lugar, el equipo confirmó en ratones modelo que la presencia de la mutación deriva en la formación de placas ateroscleróticas en la aorta, independientemente de los niveles de colesterol y otras grasas.
A continuación, a partir de diferentes experimentos (estudio histopatológico, estudios celulares, análisis de expresión y otros) los investigadores analizaron en detalle los efectos de la mutación p.Arg149Cys.
A partir de la información obtenida los investigadores han establecido que el cambio de aminoácido que produce la mutación da lugar a un mal plegamiento de la proteína, que activa una respuesta de estrés en las células. Este estrés fuerza a las células a producir más colesterol en su interior, independientemente de cuánto colesterol haya en la sangre. Finalmente, el aumento en los niveles de colesterol (en este caso internos) deriva en la formación de las placas ateroscleróticas que comprometen el flujo sanguíneo y derivan en la enfermedad cardiovascular.
Implicaciones terapéuticas del estudio
La identificación del estrés intracelular de las células musculares de los vasos sanguíneos como un nuevo mecanismo que puede dar lugar a aterosclerosis, tiene diversas implicaciones relevantes a nivel clínico.
“Este hallazgo es único en el sentido de que hemos descubierto una vía completamente nueva hacia la aterosclerosis. Esto explica por qué durante años hemos sabido que las estatinas protegen a las personas de los ataques cardíacos, incluso a aquellas cuyos niveles de colesterol en sangre son normales. En las personas con mutaciones en el gen ACTA2, las estatinas bloquean el colesterol producido por las células musculares lisas estresadas”, ha señalado Milewicz, director del estudio.
De hecho, en los ratones modelo, el equipo detectó que el tratamiento con la estatina pravastatina revertía el aumento de aterosclerosis. “Estos resultados tienen implicaciones directas para el manejo de los individuos en riesgo de enfermedad coronaria que no tienen hipercolesterolemia”, concluyen los autores del estudio. “Estos datos apoyan la utilización terapéutica de estatinas en pacientes con variantes en el gen ACTA2 en ausencia de hipercolesterolemia”.
Puesto que el estrés de las células musculares lisas asociadas a la aterosclerosis deriva en el depósito de calcio en las arterias, Milewicz también plantea que estudiar esta característica mediante imagen podría ser útil para diagnosticar de forma temprana o monitorizar el desarrollo de aterosclerosis temprana en las personas con mutaciones en ACTA2. “Esto permitiría a los médicos decidir a qué edad pueden empezar estos pacientes con estatinas”, señala el investigador.
Nuevas cuestiones para estudios futuros
Los resultados del trabajo también plantean preguntas a resolver en estudios futuros. “En nuestro estudio, la proteína mutante producida por la mutación de ACTA2 provocó que las células en la pared de la arteria estuvieran estresadas, pero hay muchos otros factores que pueden estresar a las células. Ahora estamos investigando los factores de riesgo de la enfermedad de las arterias coronarias, como la hipertensión, que también estresarían a las células y activarían esta nueva vía para la enfermedad de las arterias coronarias.”
Además, puesto que la proteína SMA se expresa prácticamente solo en las células musculares de los vasos sanguíneos, los investigadores plantean que podría haber otras variantes que tuvieran un efecto similar.
Fuente: Genética Médica News
Referencia: Kaw K, et al. Smooth muscle α-actin missense variant promotes atherosclerosis through modulation of intracellular cholesterol in smooth muscle cells. Eur Heart J. 2023 Jun 28:ehad373. doi: http://dx.doi.org/10.1093/eurheartj/ehad373https://academic.oup.com/eurheartj/article/44/29/2713/7209229?login=false
ago
24
 Investigadores de la Universidad de Cambridge han obtenido las primeras evidencias de que, durante el embarazo, el feto utiliza un gen paterno para controlar el suministro de nutrientes desde la placenta.
Investigadores de la Universidad de Cambridge han obtenido las primeras evidencias de que, durante el embarazo, el feto utiliza un gen paterno para controlar el suministro de nutrientes desde la placenta.
Durante el embarazo, el metabolismo materno se adapta para suministrar nutrientes que favorezcan el crecimiento y desarrollo fetal. La placenta, órgano temporal formado por células del feto y de la madre, actúa como intermediaria entre la madre y el feto y facilita el intercambio de nutrientes y oxígeno entre ambos. Conforme progresa el embarazo, el feto aumenta sus demandas de nutrientes para promover su crecimiento, lo que se opone, en cierto modo, a las necesidades maternas de mantener los nutrientes necesarios para su salud y prepararse para la lactancia y posibles posteriores embarazos.
A partir de estudios en ratones un equipo de la Universidad de Cambridge ha encontrado que IGF2, una señal endocrina similar a la insulina, modifica el metabolismo materno y distribución de recursos hacia el feto. Además, la señalización mediada por Igf2 participa en el desarrollo de diversos tejidos como la placenta, el hígado y el cerebro. En un estudio previo, el equipo había identificado el papel de IGF2 en el desarrollo de la vasculatura de la placenta para adaptarse al crecimiento del embrión.
Un gen de expresión paterna
Interesantemente, IGF2 está codificada por un gen con impronta genómica, de forma que únicamente la copia paterna está activa en la placenta. “Si la función de Igf2 del padre es inactivada en las células señalizadoras, la madre no produce suficiente cantidad de glucosa y lípidos disponible para su circulación”, señala Jorge Lopez-Tello, Investigador en el Departamento de Fisiología, Desarrollo y Neurociencia, así como primer firmante del trabajo, publicado en Cell Metabolism. “Por lo tanto, estos nutrientes llegan al feto en cantidades insuficientes y el feto no crece adecuadamente”.
Los investigadores plantean que la expresión de Igf2 con impronta genética en la placenta puede haber evolucionado como una estrategia para movilizar nutrientes hacia el feto en crecimiento. En este contexto, Igf2 y placenta tienen un papel central en el conflicto materno-fetal por los recursos maternos.
Impacto a largo plazo de los defectos en Igf2
Los investigadores también han determinado que la reducción en la señalización mediada por Igf2 en la placenta tiene consecuencias metabólicas postnatales. Los ratones deficientes para Igf2 mostraron un crecimiento restringido e hipoglucémico, con efectos que se extendieron a la edad adulta.
“Nuestra investigación pone de relieve lo importante que es la distribución controlada de nutrientes hacia el feto para la salud de la descendencia a lo largo de toda su vida, y el papel directo que desempeña la placenta”, ha señalado Amanda Sferruzzi, catedrática en Fisiología Fetal y de la Placenta en la Universidad de Cambridge. “La placenta es un órgano asombroso. Al final del embarazo, la madre expulsa la placenta, pero los recuerdos de cómo estaba funcionando la placenta dejan un legado duradero en la forma en que se han desarrollado los órganos fetales y en cómo van a funcionar a lo largo de la vida”.
El siguiente paso de los investigadores será determinar con mayor detalle cómo Igf2 controla las hormonas de la placenta implicadas en regulación de nutrientes y crecimiento de los órganos e identificar la función exacta de estas hormonas.
Fuente: Genética Médica News
Referencia: Lopez-Tello J, et al. Fetal manipulation of maternal metabolism is a critical function of the imprinted Igf2 gene. Cell Metab. 2023 Jul 11;35(7):1195-1208.e6. doi: http://dx.doi.org/10.1016/j.cmet.2023.06.007
https://www.sciencedirect.com/science/article/pii/S1550413123002176?via%3Dihub
ago
21
En un experimento se les administró a ratones una dieta rica en inulina y se detectó en dichos animales una mayor proliferación de células madre intestinales que en otros alimentados con fibras insolubles
 La dieta rica en fibras ha venido siendo asociada a diversos beneficios para la salud en estudios que así lo indican, incluso en lo concerniente a la protección contra enfermedades tales como el cáncer y la diabetes. Así y todo, poco se sabía acerca de la interacción entre esas fibras, los microorganismos existentes en el intestino y dicho órgano en sí mismo.
La dieta rica en fibras ha venido siendo asociada a diversos beneficios para la salud en estudios que así lo indican, incluso en lo concerniente a la protección contra enfermedades tales como el cáncer y la diabetes. Así y todo, poco se sabía acerca de la interacción entre esas fibras, los microorganismos existentes en el intestino y dicho órgano en sí mismo.
Pero un estudio realizado por científicos brasileños y publicado en la revista Microbiome revela que una dieta rica en una fibra soluble llamada inulina, presente en altas concentraciones en las raíces de la achicoria, por ejemplo, puede influir incluso sobre las características macroscópicas del intestino: en su extensión, por ejemplo.
No obstante, esta acción beneficiosa solamente se plasma en presencia de bacterias que efectúan la digestión de las fibras y generan alteraciones positivas en la inmunidad. Estos resultados aportan nuevas evidencias al respecto de la importancia de las fibras en la alimentación y pueden ayudar en la comprensión de las enfermedades intestinales inflamatorias.
“En los ratones que ingirieron una dieta con un 10 % de inulina, el intestino era mayor que el de los roedores que consumieron únicamente fibras no solubles [celulosa]. Cuando analizamos ese tejido, observamos en los animales que se alimentaron con la dieta rica en inulina una mayor proliferación de células madre del epitelio, la capa que separa el contenido intestinal de los otros órganos”, comenta Renan Oliveira Corrêa, quien llevó a cabo la investigación con el apoyo de la FAPESP durante su doctorado, en el Instituto de Biología de la Universidad de Campinas (IB-Unicamp).
Una parte de los análisis se concretó durante una pasantía que Oliveira Corrêa realizó en el Massachusetts Institute of Technology (MIT), de Estados Unidos. Este estudio forma parte de un proyecto coordinado por Marco Aurelio Ramirez Vinolo, docente del IB-Unicamp y coautor del artículo ahora publicado.
La expresión génica
Al secuenciar el ARN del epitelio intestinal de los ratones, los investigadores detectaron 268 genes expresados de manera diferenciada entre los grupos de animales (con dietas con y sin inulina). En el grupo que ingirió fibras solubles se detectó una mayor expresión de genes relacionados con el ciclo celular, con la replicación y con la reparación del ADN, sumamente importantes en el epitelio intestinal debido al alto índice de renovación de las células que lo componen.
Por otra parte, los genes asociados al metabolismo de los lípidos y los ácidos grasos mostraron una expresión menor en ese grupo de animales que ingirió inulina. Esta modulación va al encuentro de ciertos efectos que ya habían descrito otros grupos de investigación. Según dichos estudios, la ingesta de inulina disminuye los niveles de lípidos circulantes y la esteatosis hepática, que es el exceso de grasa en el hígado.
La dieta rica en inulina incrementó también la expresión de genes asociados a la diferenciación de las células epiteliales, un proceso esencial para que el órgano crezca y reemplace las células muertas. Este resultado condice con las cifras elevadas de células productoras de mucina, que forman el moco que protege al intestino humano contra las bacterias presentes en su interior y que también indican que el órgano está concretando adecuadamente sus funciones.
“Este análisis se llevó a cabo mediante la secuenciación de células individuales, quizá la primera realizada enteramente en Brasil. Este método permite saber qué expresa cada célula de la capa epitelial por separado”, afirma Ramirez Vinolo, quien coordinó otros trabajos en los cuales se demostraron los beneficios del consumo de fibras (lea más en: agencia.fapesp.br/35537)
El rol de las bacterias
La comunidad bacteriana quedó drásticamente modificada en los animales que ingirieron inulina. Para cerciorarse si las alteraciones eran importantes en el efecto de esas fibras en el epitelio, los investigadores realizaron experimentos con otros dos grupos de ratones.
Antes de administrárseles la inulina, uno de los grupos tomó un antibiótico que disminuyó la microbiota intestinal. A su vez, el otro grupo estaba conformado por animales que no tenían ningún microorganismo en sus cuerpos. Los mismos corresponden a un tipo de ratones conocidos como germ free, que nacen en un ambiente totalmente estéril y no tienen contacto con nada que pueda suministrarles microorganismos hasta el momento del experimento.
Los animales alimentados con inulina tampoco desarrollaron el fenotipo intestinal ni se registraron en ellos las alteraciones moleculares que se detectaron en el grupo que comió fibras solubles, pero cuyos integrantes tenía una microbiota normal.
“Cuando ingirieron un poco de los excrementos [trasplante fecal] de los otros que tenían bacterias en el intestino e ingirieron inulina, aun cuando nunca habían comido inulina en sí misma, estos animales desarrollaron el fenotipo intestinal, lo cual muestra el papel clave de la microbiota en esos efectos”, explica Oliveira Corrêa, en la actualidad investigador del Institut Imagine, en Francia.
Por último, con este estudio quedó demostrado que el consumo de inulina inducía una mayor producción de la molécula interleuquina 22 (IL-22), una citoquina elaborada por el sistema inmunitario importante para la salud del intestino. En los ratones que no producían IL-22 (porque se silenció en ellos el gen codificador de esta proteína), la dieta rica en inulina no indujo los efectos que se observaron en los otros animales.
La misma ausencia de efectos se observó en los animales que no expresaban linfocitos T tipo gamma-delta, un subgrupo de los linfocitos T que se ubican cerca del epitelio intestinal, lo que revela una importante función que cumplen las células inmunitarias específicas en ese contexto.
“Observamos efectos similares con otras fibras solubles como la pectina, contenida en las frutas. Es necesario realizar nuevos estudios a los efectos de entender exactamente qué hace cada fibra. Pero podemos afirmar que una dieta balanceada genera efectos cada vez más evidentes y que comprenden una compleja interacción entre los componentes de la dieta, la microbiota y las células de nuestro organismo”, informa Ramirez Vinolo.
“Es fundamental entender cómo esto funciona y cómo podemos actuar en este sistema con miras a prevenir e incluso a tratar las enfermedades inflamatorias intestinales y otras, tales como la diabetes y el asma”, culmina diciendo Ramirez Vinolo.
Fuente: Dicyt.com
Referencia: Corrêa, R.O., Castro, P.R., Fachi, J.L. et al. Inulin diet uncovers complex diet-microbiota-immune cell interactions remodeling the gut epithelium. Microbiome 11, 90 (2023). https://doi.org/10.1186/s40168-023-01520-2
ago
18
 Un factor plaquetario se une a la lista de componentes de la sangre que pueden tener efectos antienvejecimiento.
Un factor plaquetario se une a la lista de componentes de la sangre que pueden tener efectos antienvejecimiento.
Una proteína involucrada en la cicatrización de heridas puede mejorar el aprendizaje y la memoria en ratones envejecidos.
El factor plaquetario 4 (PF4) se conoce desde hace mucho tiempo por su papel en la promoción de la coagulación de la sangre y el sellado de los vasos sanguíneos rotos. Ahora, los investigadores se preguntan si esta molécula de señalización podría usarse para tratar trastornos cognitivos relacionados con la edad, como la enfermedad de Alzheimer. Read more

