may
4
 Descubiertos en los años setenta, los relojes circadianos son fundamentales para la regulación del tiempo biológico en la mayoría de las células del cuerpo humano. Estos mecanismos internos ajustan los procesos biológicos a un ciclo de 24 horas, permitiendo la sincronización de las funciones celulares con las variaciones diarias del entorno. Los ritmos circadianos, que están coordinados por un reloj central en el cerebro que se comunica con los relojes de los distintos tejidos periféricos, influyen en muchísimas funciones, desde nuestros patrones de sueño hasta nuestra capacidad para metabolizar los alimentos.
Descubiertos en los años setenta, los relojes circadianos son fundamentales para la regulación del tiempo biológico en la mayoría de las células del cuerpo humano. Estos mecanismos internos ajustan los procesos biológicos a un ciclo de 24 horas, permitiendo la sincronización de las funciones celulares con las variaciones diarias del entorno. Los ritmos circadianos, que están coordinados por un reloj central en el cerebro que se comunica con los relojes de los distintos tejidos periféricos, influyen en muchísimas funciones, desde nuestros patrones de sueño hasta nuestra capacidad para metabolizar los alimentos.
Un equipo liderado por Salvador Aznar Benitah, investigador ICREA del IRB Barcelona y Pura Muñoz-Cánoves, investigadora ICREA en el Departamento de Medicina y Ciencias de la Vida de la Universidad Pompeu Fabra (UPF), ha descubierto cómo la sincronización entre el reloj circadiano cerebral y los relojes periféricos en el músculo y la piel, es esencial para el funcionamiento adecuado de estos tejidos, así como para prevenir procesos degenerativos propios del envejecimiento.
Los resultados del estudio han sido publicados en dos artículos en revistas de alto impacto: la investigación sobre la sincronización entre el reloj central y el reloj periférico del músculo se ha publicado en Science, mientras que el estudio de la coordinación entre el reloj central y el reloj periférico de la piel se ha publicado en Cell Stem Cell. Ambos trabajos revelan mecanismos comunes que subrayan la importancia de esta coordinación para mantener la funcionalidad óptima de los músculos y la piel.
El estudio también detalla el notable grado de autonomía de los relojes periféricos, que son capaces de mantener ciclos de 24 horas y de gestionar aproximadamente un 15 % de las funciones circadianas, en ausencia del reloj central.
«Es fascinante ver cómo la sincronización entre los relojes circadianos cerebrales y periféricos desempeña un papel fundamental en la salud de la piel y el músculo, a la vez que los relojes periféricos por sí solos son autónomos para llevar a cabo las funciones más básicas del tejido.», explica Aznar Benitah, que co-lideró estos estudios como jefe del laboratorio de Células Madre y Cáncer del IRB Barcelona.
«Nuestro estudio revela que se necesita una interacción mínima de tan solo dos relojes tisulares (uno central y otro periférico) para mantener el funcionamiento óptimo de tejidos como el músculo y la piel, y evitar su deterioro y envejecimiento. Ahora, el siguiente paso es identificar los factores de señalización implicados en esta interacción, pensando en aplicaciones terapéuticas», indica Muñoz-Cánoves, investigadora en la UPF, y actualmente investigadora en Altos Labs (San Diego, EEUU).
La coordinación con el reloj periférico muscular mantiene la función muscular y previene el envejecimiento prematuro
El estudio publicado en Science se centró en la comunicación entre el cerebro y el músculo, y confirma que la coordinación entre los relojes cerebrales y periféricos es crucial para mantener la función muscular diaria y prevenir el envejecimiento prematuro del músculo. La restauración del ritmo circadiano reduce la pérdida de masa muscular y de fuerza, mejorando las funciones motoras deterioradas en modelos de estudio en ratones.
Los resultados del estudio han mostrado también que la alimentación restringida en el tiempo (Time-restricted feeding o TRF), que implica comer solo durante la fase activa del día, puede reemplazar parcialmente el reloj central y mejorar la autonomía del reloj muscular. Lo que aún es más relevante, esta restauración del ritmo circadiano a través de TRF es capaz de mitigar la pérdida muscular, el deterioro de las funciones metabólicas y motoras y la disminución de la fuerza muscular en ratones viejos.
Estos hallazgos tienen implicaciones importantes para el desarrollo de terapias contra el envejecimiento muscular y la mejora del rendimiento físico en la edad avanzada. Arun Kumar y Mireia Vaca Dempere, ambos de la UPF, son los primeros autores de este estudio, al que también han contribuido Eusebio Perdiguero y Antonio Serrano, anteriormente en la UPF y ahora en Altos Labs.
El reloj periférico de la piel integra y modula las señales cerebrales
En el estudio publicado en Cell Stem Cell, el equipo ha demostrado que el reloj circadiano de la piel es clave en la coordinación de la fisiología diaria del tejido. Mediante la integración de las señales del cerebro y, en ocasiones, modificándolas, garantiza el correcto funcionamiento de la piel.
Un hallazgo sorprendente fue que, en ausencia del reloj periférico, el reloj central del cuerpo mantiene el ritmo circadiano en la piel, pero opera de manera contraria a lo habitual (es decir, en un horario opuesto). Por ejemplo, se observó que la replicación del ADN, si solo estuviese controlada por el reloj central ocurriría durante el día, a la hora a la que la piel estaría expuesta a la luz ultravioleta, lo cual incrementaría el riesgo de acumular más mutaciones.
Este fenómeno destaca la importancia del reloj periférico, que no solo recibe señales del reloj central —que coordina los ritmos de todo el organismo— sino que además adapta estas señales a las necesidades específicas del tejido en el que reside (en el caso de la células madre de la piel, la división del ADN una vez que han pasado las horas del día en la que la exposición a la luz ultravioleta es máxima).
Thomas Mortimer, investigador postdoctoral del IRB Barcelona y Patrick-Simon Welz del Hospital del Mar Research Institute han liderado este proyecto junto a Aznar Benitah y Muñoz-Cánoves.
Los resultados de ambos estudios son fruto de una colaboración internacional, con investigadores de la University of California y la University of Texas Health en San Antonio (ambas en Estados Unidos), la University of Lübeck en Alemania, el Karolinska Institute en Suecia, la Humanitas University en Italia y Altos Labs San Diego Institute of Science en Estados Unidos.
El proyecto ha obtenido financiación del European Research Council, el programa H2020 de la Unión Europea, el Ministerio de Ciencia, Innovación y Universidades, la Generalitat de Catalunya, la Fundación Lilliane Bettencourt, la Fundación «la Caixa», la Fundación la Marató de TV3, la Fundación BBVA y la Fundación Novo Nordisk.
03 mayo 2024|Fuente: UPF |Tomado de |Noticia
may
1
 El reciente hallazgo de una proteína llamada TP53INP2 puede resultar clave en la lucha contra la sarcopenia, trastorno frecuente en la vejez que se caracteriza por la pérdida progresiva de masa y función muscular.
El reciente hallazgo de una proteína llamada TP53INP2 puede resultar clave en la lucha contra la sarcopenia, trastorno frecuente en la vejez que se caracteriza por la pérdida progresiva de masa y función muscular.
Generalmente este desgaste comienza a manifestarse a partir de los 55 años y tiene un impacto negativo en la funcionalidad y salud del individuo, pues conduce a una mayor fragilidad, riesgo de sufrir caídas y lesiones, discapacidad física, dependencia y necesidad de cuidados a largo plazo.
La sarcopenia se acelera con el transcurso de los años. Más allá de los 50 años se producen disminuciones anuales de la masa muscular del uno al dos por ciento, para llegar a los 80 años con una pérdida de hasta 45 por ciento.
Es conocido que la potencia o fuerza muscular alcanza su pico máximo entre la segunda y tercera década de la vida y declina alrededor de 1,5 puntos porcentuales anual entre las edades de 50 a 60 años, y de tres por ciento después. Un estudio liderado por los doctores Antonio Zorzano, del Instituto de Investigación en Biomedicina de Barcelona, y David Sebastián, profesor de la Universidad de Barcelona, con la colaboración del Parc Sanitari Sant Joan de Déu, mostró que niveles elevados de TP53INP2 en el músculo están asociados con una mayor fuerza muscular y un envejecimiento más saludable en humanos.
A través de experimentos en modelos de ratón y el análisis de muestras de tejido muscular humano, los investigadores descubrieron que los niveles de esta proteína disminuyen con la edad.
Tales revelaciones sugieren que fomentar la actividad de ésta y, por ende, la autofagia en el músculo, podría ser una estrategia efectiva para luchar contra la sarcopenia y promover un envejecimiento más activo y saludable.
«Este estudio no solo resalta la importancia de mantener activa la autofagia en los músculos para prevenir la pérdida de masa muscular, sino que también nos da esperanzas sobre posibles tratamientos que podrían mejorar o al menos mitigar los efectos del envejecimiento en nuestros músculos», explicó Zorzano en un artículo publicado en la revista Autophagy.
Este avance abre nuevas vías de investigación en el campo del envejecimiento, además de sugerir posibles intervenciones para mejorar significativamente la calidad de vida de las personas mayores, ayudándoles a mantener su independencia y vitalidad.
CAUSAS Y PREVALENCIA
De acuerdo con un estudio que vio la luz en la Revista Cubana de Medicina General Integral (julio-septiembre de 2019), la sarcopenia y sus consecuencias, sin lugar a dudas, representan un reto para la sociedad y el sistema de salud.
En Cuba, al concluir 2017, el número de personas de 60 años y más se elevó hasta el 19,8 % de la población, con un incremento evolutivo con respecto a 1970 de 10,8 puntos porcentuales. El proceso de envejecimiento se observó de manera más o menos intensa en todos los territorios, lo que se manifestó de forma más evidente en las provincias de La Habana, Pinar del Río, Las Villas y Sancti Spíritus.
Mientras, una de sus causas, la elevada esperanza de vida de la población, se situó en 78,45 años (2011-2013), cuando las mujeres presentaron una mayor longevidad que los hombres (80,45 frente a 76,50 años).
La sarcopenia es una entidad común en la población anciana, con una prevalencia entre nueve y 18 por ciento en mayores de 64 años y entre 11 y 50 por ciento en personas mayores de 80 años.
En un estudio donde intervinieron 651 hombres y mujeres, mayores de 60 años, residentes en diferentes barriadas habaneras, se evaluó la masa muscular apendicular y la fuerza de agarre manual para diagnosticar sarcopenia.
Según se observó, la masa muscular apendicular estuvo disminuida en 46,8 %, siendo más evidente en hombres.
Por su parte, la dinamometría fue más deficiente en mujeres (76 %) que en hombres (22), mientras 32,3 por ciento de los hombres y más del 90 % de las mujeres cumplieron con el criterio de sarcopenia.
Varios autores opinan que esta debe considerarse un síndrome geriátrico frecuente y relevante para la práctica clínica diaria.
Si consideramos que es un acompañante habitual del proceso de envejecimiento, se pudiera inferir que puede afectar al 100 % de los ancianos. Sin embargo, si introducimos el matiz de que la pérdida de masa y potencia muscular sea lo suficientemente intensas como para producir síntomas, la prevalencia será menor, se evaluó en el artículo.
Los expertos plantean varios aspectos que facilitan la aparición de la sarcopenia, entre ellos se destacan: el proceso de envejecimiento, las condiciones genéticas del individuo, la dieta inadecuada asociada a pérdida de peso desde edades tempranas, estilo de vida sedentario, enfermedades crónicas y los tratamientos con ciertas drogas.
También se mencionan los cambios hormonales producto del declive de la secreción de hormonas anabólicas -como la de crecimiento y las sexuales-, incremento de la resistencia a la acción de la insulina, la aterosclerosis, el incremento en la circulación de citoquinas pro-inflamatorias y la disminución en la densidad ósea y de la capacidad oxidativa, entre otros aspectos.
CÓMO PREVENIR O REVERTIR ESTE PADECIMIENTO
La mejor manera de prevenir o revertir la sarcopenia es sin duda alguna la actividad física y más concretamente los ejercicios de potenciación muscular, afirmó en un artículo especializado el doctor J. A. Serra Rexach, del Servicio de Geriatría del hospital general universitario Gregorio Marañón, Madrid, España.
Está ampliamente demostrado cómo este tipo de ejercicios produce en los ancianos un incremento de la masa y potencia muscular algo más pequeño en términos absolutos que los más jóvenes, pero similar en términos relativos, aseveró.
Los beneficios de estos programas de entrenamiento se obtienen en tan solo ocho semanas con ejercicios dos o tres veces por semana, habiéndose conseguido mejorías incluso en ancianos con más de 90 años.
Distintos programas de entrenamiento en ancianos demuestran un incremento de la potencia muscular entre el 30 y el 170 %, según el experto.
Además, dijo, «este incremento de la potencia muscular tiene importantes implicaciones funcionales: mayor capacidad y velocidad de marcha, mayor capacidad para subir escaleras y por lo tanto mayor capacidad para mantenerse físicamente independientes».
Asimismo la actividad física ha demostrado su utilidad para prevenir y tratar una gran cantidad de enfermedades frecuentes en los adultos mayores. Por último también está demostrado que los ancianos que llevan una vida más activa viven más años y en mejores condiciones, subrayó el especialista.
29 abril 2024|Fuente: Prensa Latina |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
abr
30
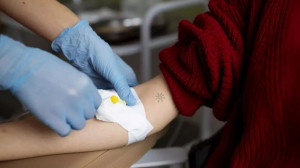 Aunque la terapia celular con CAR-T lleva décadas investigándose, los medicamentos se administran en España desde hace apenas cuatro años, abriendo horizontes para atacar enfermedades como el cáncer, ganar en supervivencia y mejorar la vida del paciente, en un campo todavía incipiente, muy prometedor y en el que aún se afronta una «curva de aprendizaje».
Aunque la terapia celular con CAR-T lleva décadas investigándose, los medicamentos se administran en España desde hace apenas cuatro años, abriendo horizontes para atacar enfermedades como el cáncer, ganar en supervivencia y mejorar la vida del paciente, en un campo todavía incipiente, muy prometedor y en el que aún se afronta una «curva de aprendizaje».
Las terapias avanzadas suponen un gran paso en el sistema sanitario y una «ventana de oportunidad» en patologías y situaciones donde otros tratamientos no llegan. Ese nuevo camino está en la terapia génica, regenerativa o celular, como las CAR-T, explica a EFE la hematóloga del Hospital Universitario Marqués de Valdecilla de Santander, Lucrecia Yáñez.
Estas terapias tienen un gran potencial para desarrollar tratamientos personalizados y representan una perspectiva de revolución en la medicina.
En el otro lado de la balanza está su elevado coste: el tratamiento de cada paciente con CAR-T puede superar los 300 000 euros.
Una de las funciones de nuestro sistema inmunológico es eliminar las células tumorales. Pero esta función se puede perder y desarrollar una formación anormal en alguna parte del cuerpo de tejido en forma de tumor. Ahí entrarían en juego las CAR-T, «un linfocito, modificado genéticamente, que reconoce específicamente a las células que tiene que matar», detalla la doctora Yáñez.
Esta terapia consiste, básicamente, en extraer linfocitos T de la propia persona, modificarlos genéticamente, e introducirlos posteriormente como un medicamento. «Pero primero hay que evaluar al paciente, porque no todos los pacientes van a poder recibir esta terapia», advierte la hematóloga de Valdecilla.
Viaje a Ámsterdam e infusión
El primer paso es la extracción de linfocitos de esa persona, que posteriormente se envían a Ámsterdam, donde se realiza la modificación genética. Esos linfocitos son «la materia prima» con la que se van a desarrollar las células CAR-T para que después vuelvan a infundirse en ese paciente.
El proceso para crear esas células se prolonga dos o tres semanas y, una vez concluido, son necesarios controles. Cuando hay una validación, se devuelven las células criopreservadas y cuando retornan al lugar de origen, donde está el paciente, se le ingresa y se le administra una linfodepleción, que es un tipo de quimioterapia que se aplica para preparar al organismo.
Ya por fin, el CAR-T se descongela y se infunde. »
Durante los primeros días pueden aparecer complicaciones, que son variables dependiendo en parte del paciente y de cómo esté controlada la enfermedad», señala la doctora Yáñez.
Tras los primeros días, y si no aparecen más complicaciones, el paciente es dado de alta y tiene un seguimiento de consulta externa, para monitorizar la enfermedad.
Éste es un procedimiento complejo y que justifica que el Ministerio de Sanidad haya seleccionado para la administración de la terapia CAR-T a centros con gran experiencia en el uso de terapias antitumorales complejas, incluyendo el trasplante de progenitores hematopoyéticos, como es el Hospital Universitario Marqués de Valdecilla de Santander.
Veinte pacientes en dos años
Valdecilla fue designado en junio de 2022 centro infusor de CAR-T, junto a otros trece más dentro de la geografía nacional, en un movimiento del Ministerio que supuso duplicar la red de terapias avanzadas en España.
Yáñez explica que realmente había una necesidad de ampliar esa red, ya que cuando se decidieron los primeros centros en todo el país no se designó ninguno en el norte, «desde Galicia hasta el País Vasco», de forma que los pacientes tenían que trasladarse a Madrid o Barcelona.
El primer paciente al que se infundió terapia CAR-T en Valdecilla fue en agosto de 2022. Hasta hoy ha habido 20 beneficiados de esta terapia y hay dos en espera de que se les administre en las próximas semanas.
De los veinte, además, tres han llegado de otras comunidades autónomas, el País Vasco y La Rioja.
La puesta en marcha y la administración de esta terapia ha requerido el trabajo de un equipo multidisciplinar de profesionales, e involucra al Hospital Marqués de Valdecilla y al Banco de Sangre y Tejidos de Cantabria. «El proceso es muy complejo y se necesita a muchas personas para llevarlo a cabo», destaca la doctora Yáñez.
28 abril 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
abr
27
 Embriones de ratón que iban a carecer del cerebro anterior o del bulbo olfativo pudieron desarrollarlos usando neuronas cultivadas a partir de células madre de rata, según dos estudios independientes que publica Cell.
Embriones de ratón que iban a carecer del cerebro anterior o del bulbo olfativo pudieron desarrollarlos usando neuronas cultivadas a partir de células madre de rata, según dos estudios independientes que publica Cell.
Estas investigaciones ofrecen conocimientos sobre cómo se forma el tejido cerebral y presentan nuevas oportunidades para restaurar la función cerebral perdida a causa de la enfermedad y el envejecimiento.
La autora principal de uno de los trabajos, Kristin Baldwin, de la Universidad de Columbia (EE.UU.), indicó que «esta investigación ayuda a mostrar la flexibilidad potencial del cerebro a la hora de utilizar circuitos neuronales sintéticos para restaurar funciones cerebrales».
Entender el desarrollo y la evolución del cerebro.
Su equipo restauró los circuitos neuronales olfativos de ratones, las neuronas interconectadas del cerebro responsables del sentido del olfato y su función utilizando células madre de ratas.
«Ser capaces de generar tejidos cerebrales de una especie dentro de otra puede ayudarnos a entender el desarrollo y la evolución del cerebro en diferentes especies», en palabras de Jun Wu de la Universidad de Texas en Dallas (EE.UU.) y autor principal de la otra investigación.
En ambos trabajos se generaron quimeras interespecíficas, que son embriones con células de dos especies diferentes, como es el caso de ratones y ratas, animales que evolucionaron de forma independiente durante aproximadamente 20 a 30 millones de años.
El equipo de Wu usó la herramienta CRISPR de edición genética para descubrir que eliminando el gen Hesx1 se podían generar ratones sin cerebro frontal.
En un proceso denominado complementación de blastocistos, los investigadores inyectaron en un blastocisto (embrión de 5 a 6 días) de ratón sin Hesx1, células madre de rata, las cuales rellenaron el nicho para formar un cerebro anterior.
Las ratas tienen cerebros más grandes que los ratones, pero los cerebros anteriores se desarrollaron al mismo ritmo y tamaño que los de los ratones.
Además, las neuronas de rata eran capaces de transmitir señales a las neuronas vecinas de ratón y viceversa, explica la publicación.
Los investigadores no probaron si el cerebro frontal procedente de células madre de rata modificaba el comportamiento de los ratones, pero Wu indicó que parece que este no estaba fuera de lo normal.
Para el segundo estudio se usaron genes específicos que eliminaban o silenciaban genéticamente neuronas sensoriales olfativas, con lo que los roedores no tenían bulbo olfativo o estaba inactivo.
El modelo de silenciamiento imita lo que se observa en los trastornos del neurodesarrollo, en los que ciertas neuronas no pueden comunicarse bien con el cerebro, y el de eliminación acaba con las neuronas por completo, simulando enfermedades degenerativas.
La complementación de blastocistos restauraba los circuitos neuronales olfativos del ratón de forma diferente según el modelo.
Si las neuronas de ratón estaban silenciadas, las de rata ayudaban a formar regiones cerebrales mejor organizadas en comparación con el modelo asesino.
Cuando el equipo probó esas quimeras rata-ratón entrenándolas para encontrar una galleta escondida en una jaula, las neuronas de rata fueron las mejores para rescatar comportamientos en el modelo de eliminación de neuronas.
Sincronizar el desarrollo con el cerebro del huésped.
Este resultado «realmente sorprendente nos permite observar las diferencias entre esos dos modelos de enfermedad e intentar identificar mecanismos que podrían ayudar a restaurar las funciones en cualquiera de los dos tipos de enfermedad cerebral», afirmó Baldwin.
La complementación de blastocistos aún está lejos de su aplicación clínica en humanos, pero ambos estudios sugieren que las células madre de distintas especies pueden sincronizar su desarrollo con el cerebro del huésped, resumió Cell.
Comentando ambos estudios, en los que no ha participado, el investigador del Centro Nacional de Biotecnología (CNB-CSIC) Lluis Montoliu destacó que «se trata de avances muy notables en neurociencias que permitirán abordar ahora muchos otros experimentos de complementación».
Llegar a resultados similares por dos laboratorios «refrenda la robustez y credibilidad de sus conclusiones y confirma la utilidad y aplicación de esta novedosa aplicación de complementación neuronal a partir de diferentes especies», dijo Montoliu citado por Science Media Centre, una plataforma de recursos científicos para periodistas.
25 abril 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
nov
27
 La terapia celular representa un potencial tratamiento regenerativo para la osteoartritis. Un análisis reciente de todos los estudios publicados relevantes indica que el trasplante de células madre de diferentes fuentes es eficaz para tratar la osteoartritis de rodilla, la enfermedad articular crónica más prevalente.
La terapia celular representa un potencial tratamiento regenerativo para la osteoartritis. Un análisis reciente de todos los estudios publicados relevantes indica que el trasplante de células madre de diferentes fuentes es eficaz para tratar la osteoartritis de rodilla, la enfermedad articular crónica más prevalente.
La revisión y el metanálisis, que se publica en el Journal of Orthopaedic Research, incluyeron 16 estudios en los que participaron 875 pacientes con osteoartritis de rodilla (441 en el grupo de trasplante de células madre y 434 en el grupo de control).
El tratamiento con células madre se asoció con reducciones significativas en el dolor informado por los pacientes a partir del tercer mes. El alivio del dolor más significativo en diferentes meses postoperatorios provino de las células madre derivadas de la grasa y del cordón umbilical.
Las células madre derivadas de grasa del propio paciente dieron como resultado un mejor alivio del dolor en comparación con las de otros donantes. Además, las células madre derivadas de la grasa del propio paciente condujeron a la recuperación más eficaz de la función de la articulación de la rodilla.
«El trasplante de células madre demostró ser seguro y eficaz para el tratamiento de la osteoartritis de rodilla», escribieron los autores. «Las diferentes fuentes de células madre tienen un buen efecto para aliviar el dolor de la articulación de la rodilla, restaurar la función de la articulación de la rodilla y minimizar el trauma del paciente».
Ver más información: Xie RH, Gong SG, Song J, Wu PP, Hu WL. Effect of mesenchymal stromal cells transplantation on the outcomes of patients with knee osteoarthritis: A systematic review and meta-analysis. J Orthop Res[Internet]. 2023[citado 26 nov 2023]; 22. doi: 10.1002/jor.25724.
27 noviembre 2023 |Fuente: IntraMed| Tomado de |Noticias médicas
(Debe de estar registrado en IntraMed)
oct
25
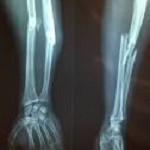 Los resultados de un ensayo de fase III confirman el valor de las células CD34+ de la médula ósea como nueva opción de tratamiento.
Los resultados de un ensayo de fase III confirman el valor de las células CD34+ de la médula ósea como nueva opción de tratamiento.
Investigadores de la Universidad de Kobe han demostrado que la inyección local de células CD34+ repara fracturas de fémur y tibia que no siguen el curso habitual de curación. El ensayo alcanzó su objetivo primario de cura radiológica a las 16 semanas en el 50 y en el 66% de los pacientes con fractura fémur y tibia, respectivamente, en comparación con controles históricos en los que no hubo ninguna cura completa de tibia en el mismo periodo de tiempo. Los científicos también constataron un incremento de los índices de unión, con desaparición de la línea de fractura, así como significativas mejoras en la calidad de vida relacionada con la salud, en algunos casos ya a las 24 semanas.
Takahiro Niikura, director del estudio, afirma que todos los efectos adversos asociados al procedimiento fueron leves o moderados y transitorios, ocurriendo principalmente durante la fase previa al trasplante celular. En el estudio los pacientes recibieron una dosificación diaria de G-CSF, citoquina que moviliza las células CD34+ desde la médula a la circulación. Esta población celular incluye progenitores endoteliales y células osteogénicas y puede ser extraída por leucoféresis y ulterior separación del resto de células mononucleares mediante un método magnético. Niikura señala que, hasta el momento, el tratamiento de este tipo de fracturas ha estado basado en la cirugía, combinada con la adición de aspirado de médula ósea o células madre mesenquimales (CMMs). Sin embargo, ningún enfoque previo había conseguido una tasa de cura del 100%, como la del actual ensayo. El científico concluye subrayando la superioridad de las células CD34+ frente a las CMMs, ya que sólo las primeras tendrían capacidad de generar los diversos tipos celulares necesarios para la reconstrucción del tejido óseo.
Kuroda R, Niikura T, Matsumoto T, Fukui T, Oe K, Mifune Y, et al. Phase III clinical trial of autologous CD34 + cell transplantation to accelerate fracture nonunion repair. BMC Med[Internet].2023[citado 23 oct 2023]; 21(386). https://doi.org/10.1186/s12916-023-03088-y
25 octubre 2023 | Fuente: IMMédico| Tomado de Noticia

