abr
29
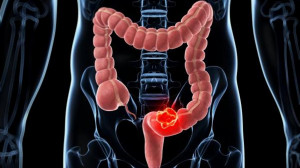
Entre el 60 y el 70% de los pacientes con cáncer de colon y recto avanzado reciben quimioterapia basada en el platino, pero la mitad de los tumores tienen la capacidad de generar resistencia en este abordaje.
En este contexto, un estudio en pacientes y modelos preclínicos de cáncer de colon y recto del Instituto Hospital del Mar de Investigaciones Médicas (IMIM-Hospital del Mar), con participación del Instituto de Investigación Sanitaria INCLIVA, el Institut Català d’Oncologia (ICO), el Vall d’Hebron Institut d’Oncologia (VHIO), el Institut de Recerca Biomèdica (IRB) de Barcelona, la Universidad de Oviedo y el CIBER del cáncer (CIBERONC), ha revelado que el oxaliplatino se acumula en las células sanas que rodean las células cancerosas y, como consecuencia, pueden hacer disminuir la sensibilidad del cáncer en el tratamiento.
El trabajo, publicado en la revista Nature Communications, destaca el protagonismo de las células no cancerosas en la respuesta a la terapia y abre la puerta a una estrategia de oncología de precisión basada en la diversidad de mecanismos de sensibilidad y una acción más personalizada.
En este trabajo, que ha contado con el apoyo del Instituto de Salud Carlos III y la Asociación Española Contra el Cáncer (TuMICC project, Junior Clinician Fellowship), los investigadores han analizado muestras de 30 pacientes con cáncer de colon y recto avanzado -antes y después de someterse a quimioterapia-, validando los resultados en modelos de ratón. Para hacerlo, se han utilizado técnicas desarrolladas en el campo de la geología aplicadas a las muestras biológicas.
Según explican Alexandre Calon, jefe del Laboratorio de Investigación traslacional en microambiente tumoral del IMIM-Hospital del Mar y líder del estudio, y Jenniffer Linares, primera autora del estudio y miembro del citado laboratorio, «se analizó la acumulación de platino en tejidos tumorales de pacientes e in vitro, en células cancerosas y sanas derivadas de pacientes».
En concreto, mediante la técnica LA-ICP-MS (Laser Ablation Inductively Coupled Plasma Mass Spectrometry) -utilizada en geología y que permite identificar la localización espacial de diferentes metales, incluido el platino-, «se estudiaron muestras tumorales parafinadas de pacientes con cáncer de colon y recto que recibieron tratamiento con quimioterapia basada en platino». Paralelamente, señalan los investigadores, se realizó ICP-MS (inductively coupled plasma-mass-spectrometry) en células cancerosas y sanas provenientes de tumores de colon para comprobar la absorción de platino al nivel celular.
Con este trabajo, apuntan Linares y Calon, «se ha podido comprobar que el platino se acumula de forma muy destacada en las células sanas que rodean al tumor, en especial en los fibroblastos, las células que contribuyen a la creación de tejidos». Además, esta acumulación se mantiene durante largos periodos de tiempo, «más de dos años después de la finalización del tratamiento».
Dos años posteriores tras el tratamiento
Tras analizarse muestras de cáncer de colon que habían sido obtenidas en diferentes tiempos después del tratamiento con platino, se observó que el patrón de acumulación de este fármaco en las células sanas se reproducía en todas las muestras analizadas, encontrándose hasta 2 años después de haberse finalizado el tratamiento.
Esta acumulación genera, a su vez, la activación de determinados genes vinculados a una mala respuesta al tratamiento con quimioterapia y a la progresión tumoral, y asociados a la activación de la vía de TGF-β en los fibroblastos, «los cuales una vez activados estimulan a las células tumorales que han sobrevivido a la quimioterapia a progresar de nuevo».
Según Calon, «la activación de los fibroblastos por el oxaliplatino puede generar mecanismos de resistencia a la misma quimioterapia». Respecto a si son los resultados esperados, Linares y Calon apuntan que «por muchos años la investigación de la resistencia a los tratamientos oncológicos se ha enfocado en el estudio de las células cancerosas. El hecho de observar una mayor acumulación del oxaliplatino en células no cancerosas es sorprendente y destaca la importancia de las células sanas que están dentro del tumor, específicamente de los fibroblastos asociados al cáncer, como causantes de la progresión tumoral y la resistencia a la quimioterapia».
Actualmente, no se dispone de marcadores predictivos de respuesta a la quimioterapia en cáncer de colon y recto. Sin embargo, el trabajo ha permitido comprobar que los niveles de otra proteína, la periostina en muestras de pacientes con cáncer de colon son un indicador de actividad de TGF-β en los fibroblastos y funcionan como un buen marcador de resistencia a la quimioterapia basada en platino.
Así, la respuesta a la quimioterapia era mala en aquellas personas en las que los niveles de periostina eran elevados antes de recibir las primeras dosis o en aquellos que eran bajos, pero se disparaban después del tratamiento. Asimismo, se comprobó que en los modelos de ratón que tenían niveles más altos de esta proteína, el tratamiento contra el tumor pierde efectividad.
Linares destaca que «hemos descubierto un mecanismo de resistencia al oxaliplatino y un marcador de esta resistencia en pacientes con cáncer de colon y recto». Un hecho que demuestra, según Calon, que hay que tener en cuenta el entorno del tumor a la hora de desarrollar los tratamientos contra el cáncer. «Las quimioterapias se evalúan en relación con su efectividad sobre las células cancerosas, no sobre las células sanas que forman el microambiente tumoral, que protege al tumor». Para Clara Montagut, jefa de sección de tumores gastrointestinales del Hospital del Mar e investigadora del CiberONC, este estudio es un paso importante para entender por qué el tratamiento de quimioterapia no funciona igual en todos los pacientes con cáncer, y poder prevenir o revertir la resistencia a la quimioterapia.
El siguiente paso crítico será desarrollar estrategias farmacológicas que actúen sobre la célula cancerosa y modulen el microambiente a favor de la eliminación del tumor».
Abril 29/2023 (Diario Médico) – Tomado de Oncología – Novedosos datos en ‘Nature Communication’ Copyright Junio 2018 Unidad Editorial Revistas, S.L.U.
abr
29
Un estudio publicado en International Journal of Infectious Diseases, coordinado desde la Universidad CEU San Pablo en colaboración con el Instituto de Salud Carlos III, señala que la carga clínica de la influenza está aumentando en todo el mundo. El envejecimiento, la inmunosupresión y las enfermedades respiratorias subyacentes son determinantes de malos resultados clínicos, incluida una mayor mortalidad.
Las infecciones bacterianas parecen ser la razón principal, por lo que la información actualizada sobre el papel de la infección bacteriana como causa de complicaciones es valiosa para mejorar el pronóstico de los pacientes con influenza.
Esta evaluación es precisamente la que han llevado cabo los grupos de investigadores, analizando datos de 48.000 pacientes de gripe provenientes de 135 investigaciones de 28 países que ha concluido que la gripe, junto con una neumonía bacteriana, podría incrementar más de tres veces el riesgo de muerte (3,4 veces) por lo que prevenir neumonías bacterianas es especialmente importante cuando surge una infección por el virus de la gripe.
La investigación, en la que también han participado los hospitales Gregorio Marañón y 12 de Octubre, de Madrid, y la Universidad Internacional de La Rioja (UNIR), también sugiere que se pueden estar infradiagnosticando las complicaciones bacterianas en casos de gripe y señala la necesidad de afrontar estrategias de prevención, diagnóstico y tratamiento antibiótico en casos con un riesgo alto de complicaciones asociadas a las infecciones gripales.
Los resultados alcanzados han sido validados de forma independiente mediante la plataforma TrietX. Estos apuntan hacia las infecciones pulmonares bacterianas como uno de los factores de riesgo más relevantes en infecciones por virus de la gripe. «Algunas de las bacterias que causan estas neumonías secundarias pueden vivir en nuestro cuerpo y colonizar nuestro aparato respiratorio superior o infectarnos desde el exterior. Las más habituales, como Streptococcus pneumoniae y Staphylococcus aureus, son responsables de más del 60% de las neumonías bacterianas asociadas a la gripe», detallan Javier Arranz-Herrero y Jesús Presa.
Los investigadores han hallado también que algunas enfermedades hematológicas crónicas presentan un riesgo similar, seguidas del riesgo asociado a desórdenes neurológicos, insuficiencia renal, inmunosupresión, enfermedades hepáticas o cardiovasculares crónicas, además de otras condiciones.
La prevención de neumonías bacterianas es, por tanto, una de las claves. Así, el estudio también pone de manifiesto la necesidad de afrontar estrategias de prevención, diagnóstico y tratamiento antibiótico en casos donde exista un riesgo alto de complicaciones asociadas a las infecciones gripales.
La gripe es una enfermedad causada por distintos virus Influenza: «A pesar de lo habituados que estamos a la palabra gripe, esta enfermedad se relaciona en España con más fallecimientos que los producidos por accidentes de tráfico. Existen distintas condiciones físicas, de edad, o enfermedades que hacen que los pacientes que desarrollen gripe tengan un riesgo alto de sufrir complicaciones y de morir», añade Nistal Villán.
En este sentido, los resultados apuntan a que la prevención mediante la vacunación, junto con medidas de contención de salud pública, el diagnóstico precoz y el tratamiento adecuado de las infecciones bacterianas para prevenir la posible aparición de otras bacterias cada vez más resistentes a antibióticos, son factores clave para mejorar el pronóstico de los pacientes con infecciones gripales.
La crisis actual de la covid-19 ha puesto de relieve la urgente necesidad de desarrollar nuevas estrategias que permitan mejorar nuestro sistema de salud para identificar y reducir riesgos concretos, señala el trabajo. La población infantil y las personas de edad avanzada son los grupos de mayor riesgo de sufrir complicaciones por la gripe. «Se trata de enfatizar con valores concretos los puntos débiles que deben de tenerse en cuenta para afrontar una mejor atención frente a la gripe», indican los primeros autores del estudio.
Abril 28/2023 (Diario Médico) – Tomado de Microbiología y Enfermedades Infecciosas – Análisis en ‘International Journal of Infectious Diseases’ Copyright Junio 2018 Unidad Editorial Revistas, S.L.U. Todos los derechos reservados.
abr
27
El MD Anderson Cancer Center de la Universidad de Texas y Generate:Biomedicines han anunciado hoy una colaboración estratégica para descubrir y desarrollar conjuntamente tratamientos proteicos para hasta cinco dianas oncológicas en cánceres avanzados, incluido el cáncer de pulmón microcítico y no microcítico.
En virtud del acuerdo de codesarrollo y comercialización, el MD Anderson y Generate:Biomedicines contribuirán cada uno a crear terapias optimizadas, potencialmente las mejores de su clase, que puedan avanzar rápidamente hacia ensayos clínicos de prueba de concepto. El acuerdo combina las capacidades integradas de aprendizaje automático de Generate:Biomedicines y las capacidades experimentales/de laboratorio húmedo -que son impulsadas por The Generate Platform- con la experiencia en investigación clínica del MD Anderson y las capacidades de investigación traslacional y desarrollo de fármacos de la plataforma Translational Research to AdvanCe Therapeutics and Innovation in Oncology (TRACTION).
«Junto con Generate:Biomedicines, nuestro objetivo es aprovechar los rápidos avances en IA generativa para desarrollar nuevos medicamentos diseñados específicamente para aquellos que no se benefician de los tratamientos existentes o que tienen cánceres resistentes a los medicamentos que requieren nuevas opciones», dijo Timothy Heffernan, Ph.D., vicepresidente de Investigación Oncológica de TRACTION en el MD Anderson. «Al unir la Plataforma Generate con nuestro enfoque integrado de investigación traslacional y desarrollo de fármacos, esperamos escalar con éxito el descubrimiento y desarrollo de fármacos de una manera que ha eludido los métodos tradicionales de ensayo y error.»
Aprovechando la escalabilidad de la Plataforma Generate, los investigadores de TRACTION y de toda la empresa de investigación del MD Anderson acelerarán el ritmo de desarrollo de fármacos e informarán sobre la traslación clínica. TRACTION es un componente central de la división Therapeutics Discovery del MD Anderson que despliega un motor de biología traslacional totalmente integrado para superar los retos tradicionales en el descubrimiento de fármacos oncológicos.
«Nuestra colaboración con el MD Anderson es una encarnación de la investigación innovadora y cooperativa destinada a maximizar el impacto clínico de las nuevas terapias en oncología», dijo el director médico de Generate:Biomedicines, Alex Snyder, M.D. «Juntos, nuestro objetivo es desplegar una tecnología disruptiva que nos permitirá reimaginar completamente la forma en que identificamos y perseguimos objetivos terapéuticos, con el objetivo de crear nuevas terapias para los pacientes más rápido que nunca.»
Según los términos del acuerdo, Generate:Biomedicines y MD Anderson compartirán los gastos de investigación y desarrollo, así como los fondos generados a través de la comercialización de los productos que surjan de la colaboración. Las organizaciones también prevén que el MD Anderson actúe como centro y recomiende investigadores principales para los ensayos clínicos de fase I y II de cualquier candidato a producto terapéutico desarrollado conjuntamente.
Abril 27/2023 (EurekaAlert!) – Tomado de NEWS RELEASE Copyright 2023 by the American Association for the Advancement of Science (AAAS).
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
27
En un descubrimiento que podría mejorar la supervivencia de los pacientes con cáncer de vejiga, científicos de Northwestern Medicine han desarrollado una prueba de firma de biomarcadores para predecir qué tumores responderán a la inmunoterapia.
Los fármacos de inmunoterapia de punto de control, que activan el sistema inmunitario del organismo para que reconozca un tumor, sólo son eficaces en un 20% de los casos de cáncer de vejiga. Pero los clínicos desconocen qué pacientes se beneficiarán y por qué no son más eficaces para todos.
En el nuevo estudio -con múltiples colaboradores internacionales- los investigadores de la Facultad de Medicina Feinberg de la Universidad Northwestern identificaron tres tipos de tumores que podrían responder a la inmunoterapia y dos que no. Mediante una combinación de perfiles de expresión génica, mutaciones y proteómica espacial, los científicos también analizaron los cánceres que no respondían para identificar posibles nuevos fármacos y terapias que pudieran utilizarse para hacerlos sensibles a la inmunoterapia.
El estudio se publicará el 27 de abril en Nature Communications.
El cáncer de vejiga, suele ser letal y no ha experimentado mejoras en la supervivencia en los últimos 30 años.
«La inmunoterapia ha cambiado la forma de tratar el cáncer de vejiga, pero tiene importantes limitaciones, ya que la mayoría de los pacientes no responden al tratamiento», afirma el Dr. Joshua Meeks, investigador principal, profesor asociado de urología en Feinberg y urólogo de Northwestern Medicine. «A miles de pacientes se les extirpa la vejiga cada año, y tratar a estos pacientes con inmunoterapia podría mejorar la supervivencia y aumentar potencialmente sus posibilidades de conservar la vejiga en lugar de extirpársela quirúrgicamente».
En este estudio, los investigadores comenzaron con un ensayo de fase II de 82 pacientes tratados con Keytruda (una inmunoterapia) antes de la extirpación de la vejiga. Se trataba de un ensayo único que evaluaba el perfil de expresión génica antes y después de Keytruda, con la capacidad de medir completamente la respuesta a Keytruda cuando se extirpaba la vejiga. Normalmente, Keytruda y otras inmunoterapias se utilizan en pacientes con cáncer metastásico, y los cambios biológicos que se producen en el tumor no se pueden monitorizar con biopsias tumorales. Mediante el perfil del transcriptoma, las alteraciones del ADN y los cambios espaciales que se producían en los tumores tratados con Keytruda, los investigadores pudieron identificar qué características se asociaban con la respuesta o la resistencia.
Por ejemplo, un tercio de los tumores pertenecían a un subtipo con muy pocas células inmunitarias infiltradas en el tumor, pero con una mayor expresión de la vía oncogénica regulada por FGFR3 y una nueva red reguladora de genes activados por un regulador epigenético KDM5B. Dirigiéndose al FGFR3 o al KDM5B, los investigadores podrían volver a despertar una respuesta inmunitaria. Dentro de un año se iniciarán en Northwestern Medicine ensayos clínicos con nuevas combinaciones de medicamentos e inmunoterapia para superar la resistencia inmunitaria.
Además, las conclusiones del estudio también proporcionan «un atlas genómico del cáncer más funcional», afirmó Meeks, que también es catedrático de Urología Edward Schaeffer, M.D., Ph.D. y miembro del Centro Oncológico Integral Robert H. Lurie de la Universidad Northwestern. «El atlas genómico actual examina los componentes fundamentales del cáncer de vejiga, pero no describe ningún tratamiento. Eso es lo que hace significativa esta evaluación. Se trata de cómo responde el cáncer de vejiga a la inmunoterapia».
El Atlas del Genoma del Cáncer es un programa de genómica del cáncer del Instituto Nacional del Cáncer que caracterizó molecularmente más de 20.000 cánceres primarios. El autor principal de este trabajo, el Dr. A. Gordon Robertson, fue también investigador principal del atlas genómico del cáncer de vejiga.
Los hallazgos fueron el resultado de múltiples colaboraciones con grupos internacionales que podían realizar ensayos con inmunoterapia que no estaban disponibles en EE.UU. «Gracias a los esfuerzos científicos en equipo, pudimos aprovechar distintos conocimientos especializados y muestras poco comunes de ensayos clínicos para responder a preguntas importantes sobre qué pacientes responderán a la inmunoterapia para el tratamiento del cáncer de vejiga», afirmó Meeks.
Los científicos de Northwestern colaboraron con investigadores clínicos principales de Italia (Dr. Andrea Necchi) y el Reino Unido (Dr. Thomas Powles.) para desarrollar un biomarcador con bioinformáticos de Canadá y Francia (Clarice Groeneveld). A continuación, los investigadores validaron este biomarcador en una tercera cohorte que trataba a pacientes de todo el mundo.
La investigación se financió principalmente con fondos del Polsky Urologic Cancer Institute del Robert H. Lurie Comprehensive Cancer Center de la Northwestern University en el Northwestern Memorial Hospital, la AACR-Bayer Innovation and Discovery Grant, el Departamento de Defensa de EE.UU. y la Veterans Health Administration.
Abril 27/2023 (MedicalXpress) – Tomado de Immunology Copyright Medical Xpress 2011 – 2023 powered by Science X Network.
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
27
Investigadores de la Universidad de Oxford (Reino Unido) han estudiado la evolución de las propiedades de resistencia a los antibióticos de los péptidos antimicrobianos (AMP). En el artículo «The evolution of colistin resistance increases bacterial resistance to host antimicrobial peptides and virulence» (La evolución de la resistencia a la colistina aumenta la resistencia bacteriana a los péptidos antimicrobianos del huésped y la virulencia), publicado en eLife, los investigadores detallan un inquietante descubrimiento sobre cómo un tipo específico de agente antimicrobiano, la colistina, podría estar entrenando a E. coli y posiblemente a otros patógenos para evadir mejor el sistema inmunitario humano.
Los péptidos antimicrobianos (AMP) son moléculas multifuncionales que se encuentran en todas las formas de vida y forman parte esencial del sistema inmunitario innato de los animales. Modulan la respuesta inmunitaria y defienden contra los patógenos invasores matando bacterias, levaduras, hongos y virus, e incluso pueden atacar a las células cancerosas. Además, son moléculas evolutivamente muy conservadas en organismos que van desde los procariotas hasta los seres humanos.
Este aspecto altamente conservado y naturalmente capacitado de los AMP es probablemente la razón por la que tienen tanto éxito en la lucha contra patógenos que de otro modo serían resistentes y la principal causa de preocupación en el estudio. Si el uso antropogénico de los AMP puede impulsar la resistencia a los AMP como tratamiento, también podría estar impulsando la evolución de la resistencia cruzada al sistema inmunitario innato de humanos y animales.
Según el Programa de las Naciones Unidas para el Medio Ambiente (PNUMA), la resistencia a los antimicrobianos es una amenaza mundial creciente. Aunque los antimicrobianos han sido un método de referencia para evitar la muerte por todo tipo de infecciones, su eficacia está ahora en peligro, ya que los tratamientos que antes funcionaban de forma fiable ya no lo hacen porque los microorganismos han creado resistencia a ellos.
La colistina es un AMP derivado de un bacilo bacteriano que se utilizó ampliamente en la agricultura a partir de la década de 1980. Tras un brote de E. coli resistente a la colistina en China, la práctica se prohibió en 2016. En la actualidad, la colistina se utiliza principalmente para infecciones graves resistentes a otros muchos antibióticos. Es una última línea de defensa cuando otras opciones han fallado, por lo que la evolución patógena de la resistencia a la colistina tendría consecuencias terribles. Lo que los investigadores encontraron en su estudio apunta a algo mucho peor.
Los investigadores probaron E. coli con el gen de resistencia a la colistina MCR-1 contra AMP humanos y animales y descubrieron, por término medio, que los plásmidos MCR proporcionaban una mayor resistencia a los AMP del huésped en un 62%.
En un experimento con suero sanguíneo, los investigadores hallaron altos niveles de resistencia al suero humano, lo que demuestra que MCR-1 protege eficazmente incluso contra mezclas complejas de antimicrobianos. El equipo aisló aún más el experimento con una versión de la cepa analizada que carecía de MCR-1 (mediante knockout del gen) y descubrió que se comportaba como una de tipo salvaje, señalando al gen MCR-1 resistente a la colistina como el impulsor de la resistencia.
Los resultados plantean la posibilidad de que la mayor resistencia a los AMP proporcionada por MCR-1 pueda aumentar la invasión bacteriana de los huéspedes al comprometer su inmunidad innata. Si no se controla, la pérdida de una defensa terapéutica crítica contra patógenos multirresistentes que adquieren genes resistentes a los AMP podría afectar a la capacidad de los profesionales clínicos para combatirlos eficazmente. Tal vez exista un riesgo aún mayor de que los patógenos «normales», actualmente combatidos por nuestro sistema inmunitario innato, se vuelvan inmunes a nosotros.
Abril 27/2023 (MedicalXpress) – Tomado de Immunology Copyright Medical Xpress 2011 – 2023 powered by Science X Network.
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
27
Según el estudio más de 200.000 personas en todo el mundo padecen Esclerosis Lateral Amiotrófica (ELA), una enfermedad progresiva del sistema nervioso que afecta a las células nerviosas del cerebro y la médula espinal.
Actualmente no existe cura para la ELA. La mayoría de las personas que padecen la enfermedad mueren en un plazo de tres a cinco años de diagnóstico de insuficiencia respiratoria. Alrededor del 10% de los enfermos de ELA viven más de 10 años. Alrededor del 20% de los casos de ELA familiar están causados por una mutación en el gen SOD1.
¿Qué es la ELA?
La ELA ataca específicamente a un tipo de células nerviosas denominadas motoneuronas. A medida que las neuronas motoras disminuyen, el sistema nervioso deja de ser capaz de enviar mensajes a los músculos, lo que provoca que éstos se debiliten y dejen de funcionar. A medida que la enfermedad avanza, los enfermos de ELA acaban siendo incapaces de mantenerse en pie o caminar sin ayuda, así como tampoco pueden utilizar las manos ni los brazos. Las personas con ELA también pueden experimentar dificultades para hablar, comer y respirar.
La mayoría de los casos de ELA se consideran esporádicos, lo que significa que se dan en personas sin antecedentes familiares de la enfermedad. Sin embargo, alrededor del 10% de los casos de ELA se consideran familiares, lo que significa que la enfermedad es hereditaria.
Según el Dr. Toby Ferguson, vicepresidente y director de la Unidad de Desarrollo Neuromuscular de Biogen, la SOD1-ALS es una forma genética rara de ELA diagnosticada en aproximadamente 330 personas en Estados Unidos.
«Puede avanzar rápidamente, siempre es mortal y puede tener un impacto devastador en las familias durante generaciones», declaró a Medical News Today. «De aprobarse, el tofersén representaría un nuevo avance científico para la comunidad de la ELA al ser el primer y único tratamiento dirigido a una causa genética de la ELA. Esperamos que esto allane el camino para nuevos avances en esta implacable enfermedad.»
¿Cómo funciona el tofersén?
Ferguson explicó que tofersen es un oligonucleótido antisentido (ASO) que se está evaluando para el tratamiento de la SOD1-ALS.
«Los ASO son cadenas cortas y sintéticas de nucleótidos diseñadas para unirse selectivamente al ARN diana y regular la expresión génica», explicó. «En las personas con SOD1-ALS, las mutaciones en el gen SOD1 hacen que su organismo genere una forma tóxica de la proteína SOD1. Esta forma tóxica de la proteína SOD1 provoca la degeneración de las motoneuronas, lo que da lugar a una debilidad muscular progresiva.»
«Tofersen está diseñado para unirse y degradar el ARNm de SOD1 en un esfuerzo por reducir la producción de la proteína SOD1″, añadió Ferguson.
Resultados de la fase 3
Ferguson dijo que los datos integrados de 12 meses del ensayo clínico de fase 3 VALOR y su extensión abierta (OLE) han mostrado reducciones en neurofilamento – un marcador de daño a las neuronas y neurodegeneración.
«Existe una amplia bibliografía que indica que los niveles de neurofilamento son pronósticos de la progresión de la enfermedad y la supervivencia, con niveles más altos asociados con (una) disminución más rápida de la función clínica y una supervivencia más corta», añadió Ferguson. «La combinación de estos resultados de biomarcadores y los datos de resultados clínicos proporcionan pruebas adicionales del potencial de tofersen para ralentizar eficazmente la progresión de la SOD1-ALS».
Biogen afirma en su comunicado de prensa que tofersén no alcanzó el criterio de valoración primario de cambio desde el valor basal hasta la semana 28 en la Escala Revisada de Valoración Funcional de la Esclerosis Lateral Amiotrófica (ALSFRS-R). Sin embargo, los investigadores descubrieron que tofersén provocaba un menor deterioro de la función motora, la función respiratoria, la fuerza muscular y la calidad de vida en personas con SOD1-ALS.
El proceso de aprobación
El 22 de marzo, el Comité Asesor sobre Fármacos para el Sistema Nervioso Central y Periférico de la FDA presentó su propia evaluación de la eficacia del tofersén.
Según un comunicado de prensa de Biogen, el comité asesor declaró que la eficacia del fármaco experimental no era suficiente. Sin embargo, el comité consultivo declaró que la capacidad de tofersen para reducir la concentración plasmática de la cadena ligera de neurofilamentos (NfL) es «razonablemente probable» que proporcione un beneficio clínico a las personas con SOD1-ALS.
«Se trata de un avance monumental en el campo de la ELA, en el que las medidas objetivas sensibles a los cambios inducidos por el tratamiento, especialmente en las fases iniciales de la enfermedad, son muy demandadas», afirmó Ferguson. «Nos encontramos aquí en gran parte debido al trabajo que la comunidad de la ELA ha realizado para caracterizar el comportamiento del neurofilamento durante la última década».
«Aunque la idoneidad del neurofilamento como posible sustituto se evaluará caso por caso, esperamos que los datos del programa tofersen sean un catalizador adicional para el uso del neurofilamento y otros biomarcadores novedosos en el futuro», añadió.
Abril 26/2023 (Medical News Today) – Tomado de Latest News Copyright 2023 Healthline Media UK Ltd, Brighton, UK.
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator