abr
30
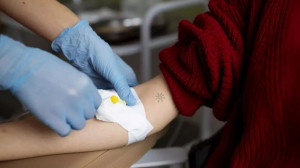 Aunque la terapia celular con CAR-T lleva décadas investigándose, los medicamentos se administran en España desde hace apenas cuatro años, abriendo horizontes para atacar enfermedades como el cáncer, ganar en supervivencia y mejorar la vida del paciente, en un campo todavía incipiente, muy prometedor y en el que aún se afronta una «curva de aprendizaje».
Aunque la terapia celular con CAR-T lleva décadas investigándose, los medicamentos se administran en España desde hace apenas cuatro años, abriendo horizontes para atacar enfermedades como el cáncer, ganar en supervivencia y mejorar la vida del paciente, en un campo todavía incipiente, muy prometedor y en el que aún se afronta una «curva de aprendizaje».
Las terapias avanzadas suponen un gran paso en el sistema sanitario y una «ventana de oportunidad» en patologías y situaciones donde otros tratamientos no llegan. Ese nuevo camino está en la terapia génica, regenerativa o celular, como las CAR-T, explica a EFE la hematóloga del Hospital Universitario Marqués de Valdecilla de Santander, Lucrecia Yáñez.
Estas terapias tienen un gran potencial para desarrollar tratamientos personalizados y representan una perspectiva de revolución en la medicina.
En el otro lado de la balanza está su elevado coste: el tratamiento de cada paciente con CAR-T puede superar los 300 000 euros.
Una de las funciones de nuestro sistema inmunológico es eliminar las células tumorales. Pero esta función se puede perder y desarrollar una formación anormal en alguna parte del cuerpo de tejido en forma de tumor. Ahí entrarían en juego las CAR-T, «un linfocito, modificado genéticamente, que reconoce específicamente a las células que tiene que matar», detalla la doctora Yáñez.
Esta terapia consiste, básicamente, en extraer linfocitos T de la propia persona, modificarlos genéticamente, e introducirlos posteriormente como un medicamento. «Pero primero hay que evaluar al paciente, porque no todos los pacientes van a poder recibir esta terapia», advierte la hematóloga de Valdecilla.
Viaje a Ámsterdam e infusión
El primer paso es la extracción de linfocitos de esa persona, que posteriormente se envían a Ámsterdam, donde se realiza la modificación genética. Esos linfocitos son «la materia prima» con la que se van a desarrollar las células CAR-T para que después vuelvan a infundirse en ese paciente.
El proceso para crear esas células se prolonga dos o tres semanas y, una vez concluido, son necesarios controles. Cuando hay una validación, se devuelven las células criopreservadas y cuando retornan al lugar de origen, donde está el paciente, se le ingresa y se le administra una linfodepleción, que es un tipo de quimioterapia que se aplica para preparar al organismo.
Ya por fin, el CAR-T se descongela y se infunde. »
Durante los primeros días pueden aparecer complicaciones, que son variables dependiendo en parte del paciente y de cómo esté controlada la enfermedad», señala la doctora Yáñez.
Tras los primeros días, y si no aparecen más complicaciones, el paciente es dado de alta y tiene un seguimiento de consulta externa, para monitorizar la enfermedad.
Éste es un procedimiento complejo y que justifica que el Ministerio de Sanidad haya seleccionado para la administración de la terapia CAR-T a centros con gran experiencia en el uso de terapias antitumorales complejas, incluyendo el trasplante de progenitores hematopoyéticos, como es el Hospital Universitario Marqués de Valdecilla de Santander.
Veinte pacientes en dos años
Valdecilla fue designado en junio de 2022 centro infusor de CAR-T, junto a otros trece más dentro de la geografía nacional, en un movimiento del Ministerio que supuso duplicar la red de terapias avanzadas en España.
Yáñez explica que realmente había una necesidad de ampliar esa red, ya que cuando se decidieron los primeros centros en todo el país no se designó ninguno en el norte, «desde Galicia hasta el País Vasco», de forma que los pacientes tenían que trasladarse a Madrid o Barcelona.
El primer paciente al que se infundió terapia CAR-T en Valdecilla fue en agosto de 2022. Hasta hoy ha habido 20 beneficiados de esta terapia y hay dos en espera de que se les administre en las próximas semanas.
De los veinte, además, tres han llegado de otras comunidades autónomas, el País Vasco y La Rioja.
La puesta en marcha y la administración de esta terapia ha requerido el trabajo de un equipo multidisciplinar de profesionales, e involucra al Hospital Marqués de Valdecilla y al Banco de Sangre y Tejidos de Cantabria. «El proceso es muy complejo y se necesita a muchas personas para llevarlo a cabo», destaca la doctora Yáñez.
28 abril 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
abr
18
 La inmunoterapia representa un enfoque cada vez más frecuente frente a las alergias porque permite combatirlas desde dentro y de raíz, modificar el curso de la enfermedad y controlar la sintomatología intensa que no responde a otros tratamientos, con una indicación en aumento para evitar la aparición de complicaciones mayores.
La inmunoterapia representa un enfoque cada vez más frecuente frente a las alergias porque permite combatirlas desde dentro y de raíz, modificar el curso de la enfermedad y controlar la sintomatología intensa que no responde a otros tratamientos, con una indicación en aumento para evitar la aparición de complicaciones mayores.
«Afortunadamente los tratamientos están evolucionando a la vez que evolucionan las patologías», subraya. en una entrevista con EFE, la especialista de Alergología del Hospital Sierrallana de Torrelavega (Cantabria) Aurora Gutiérrez.
Explica que ahora mismo existe una gama importante de fármacos biológicos para poder tratar los casos más graves de asma, de dermatitis atópica o de urticaria, «que son patologías a veces muy incapacitantes».
Además, la inmunoterapia es una herramienta muy útil en Alergología, destaca.
«Llevamos muchos años utilizando este tipo de vacunas que también se van actualizando a medida que se conoce más sobre los mecanismos de producción de las alergias», advierte esta especialista, que agrega que, de este modo, se consiguen frenar o controlar los síntomas de la alergia y evitar la evolución de la enfermedad.
Las ‘vacunas de alergias’, según abunda esta doctora, se reservan para casos en los que la clínica es muy intensa a pesar de estar realizando un tratamiento sintomático adecuado, aunque «esta actitud está cambiando y se está ampliando su indicación en determinados pacientes», como la población pediátrica.
«En los niños con rinoconjuntivitis alérgica se intenta instaurar antes, ya que hemos visto que en algunos casos se puede evitar la aparición de asma alérgico», comenta.
Esta época del año primaveral es complicada, sobre todo para los pacientes alérgicos al polen. La doctora Gutiérrez explica que las lluvias ayudan a limpiar la atmósfera, pero si finalmente llega una primavera predominantemente seca y cálida, habrá mayor carga de polen en el ambiente y a esto último se une la contaminación atmosférica.
Esta concurrencia de factores hace que las partículas que están en el ambiente sean más agresivas y causen mayor inflamación de la vía aérea, y más problemas a las alérgicos.
En las consultas de Alergología notan un aumento importante de la derivación de pacientes nuevos y, también, en el caso de los que están en seguimiento se percibe empeoramiento del control de los síntomas que obliga a hacer ajustes en el tratamiento.
Generalmente, los síntomas que presentan estos pacientes son los estornudos, moqueo, lagrimeo, picor nasal y ocular, y algunos de ellos presentan dificultad respiratoria por un asma alérgico. Otros pacientes también pueden presentar brotes de urticaria o empeoramiento de la dermatitis atópica de base.
Se recomienda que los pacientes acudan al especialista cuando todos estos síntomas interfieren en su calidad de vida. En estos casos se pueden beneficiar de un estudio de alergias para saber un poco qué es lo que está ocurriendo y pautar un tratamiento.
La prevalencia de alergias ha crecido y actualmente se estima que un 30 % de la población de España tiene algún problema de este tipo. «Los especialistas tenemos la sensación de que este porcentaje va en aumento», dice Gutiérrez, que considera las alergias «un problema grave de salud pública».
También cree que cada vez más la población está más concienciada sobre los problemas de alergia porque afectan a la calidad de vida.
El aumento de los alérgicos se debe «a múltiples factores» y es un fenómeno que está «en constante investigación». «A los especialistas nos interesa mucho», señala Gutiérrez, que cita estudios que afirman «que determinados factores, como el cambio climático, la contaminación, el hábito sedentario o el tabaquismo», están detrás de este crecimiento.
Cuando un paciente acude a una consulta de Alergología, lo primero es realizar una entrevista. Se le hacen unas preguntas con las que se cataloga el tipo de problema y se planifica un estudio. Se hacen pruebas en la piel de los antebrazos con múltiples alérgenos alimentarios y ambientales y, al testarlo, se consigue saber qué sustancias son las que están causando la situación clínica al paciente.
También se solicitan analíticas de sangre con las que realizar un diagnóstico molecular, que consiste en identificar en concreto las proteínas de los alérgenos que están causando el problema al paciente, lo que permite «hacer una medicina de precisión».
Y se pueden hacer otras pruebas, como por ejemplo la espirometría, que sirve para medir la capacidad respiratoria y saber si está alterada o no.
17 abril 2024|Fuente: EFE |Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2023. Agencia Informativa Latinoamericana Prensa Latina S.A.|Noticia
mar
28
La SEOM destaca los avances en la medicina de precisión o la inmunoterapia frente al cáncer de colon
La Sociedad Española de Oncología Médica (SEOM) ha destacado los avances que se han dado en los últimos años en la estrategia terapéutica frente al cáncer colorrectal, gracias a la incorporación de la medicina de precisión, la mayor caracterización de subgrupos de este tipo de cáncer y la inmunoterapia.
Asimismo, para la SEOM los programas de cribado que vienen implantando las comunidades autónomas de forma progresiva son básicos para disminuir la mortalidad, estimándose que podrían evitar un tercio de las muertes por cáncer colorrectal y salvar más de 3.600 vidas al año en España.
Coincidiendo con el Día Mundial del Cáncer de Colon que se conmemora el próximo domingo 31 de marzo, dentro de la campaña de comunicación ‘En Oncología, cada avance se escribe en mayúsculas’, la SEOM ha repasado los avances más importantes en cáncer colorrectal que han supuesto que la supervivencia por este tipo de tumor se haya duplicado en los últimos 20 años.
En este sentido, la sociedad señala que el cáncer colorrectal será el tumor más frecuentemente diagnosticado en España en 2024 de forma global con 44.294 nuevos casos -27.009 en varones y 17.285 en mujeres-.
Cuando se desglosa por sexos, es superado por el de próstata en varones -30.316 nuevos casos- y el de mama en mujeres -36.395 nuevos casos. Además, asegura que es una causa muy importante de muerte, ya que, en el año 2022, en varones fue la segunda causa de muerte por tumores por detrás del cáncer de pulmón. En las mujeres supuso la tercera causa de mortalidad por cáncer, por detrás del cáncer de mama y el de pulmón.
La importancia de la detección precoz
El factor pronóstico más relevante en la supervivencia del cáncer colorrectal es el estadio, por lo que la SEOM afirma que los programas de detección precoz son esenciales para detectar y tratar las lesiones premalignas antes de que se desarrolle el tumor, y también para que el diagnóstico del tumor se realice en estadios precoces.
La supervivencia a los cinco años de los pacientes con cáncer de colon en estadios precoces supera el 90 por ciento, mientras que en estadios más avanzados se sitúa en torno al 50-70 por ciento. Para la SEOM, pese al incremento constante de las perspectivas de supervivencia de los pacientes con cáncer colorrectal avanzado, los resultados están lejos de ser plenamente satisfactorios.
Por ello, apunta que es preciso tener en cuenta que un porcentaje de pacientes no despreciable con metástasis puede curarse, ya que un 20 por ciento de los pacientes a los que se le somete a cirugía de metástasis no muestran signos de enfermedad a los cinco años.
Además, señala que los análisis retrospectivos han mostrado tasas de supervivencia a los cinco años tras la cirugía de las metástasis de hasta un 70 por ciento, ‘lo cual constituye un hito y un gran avance en nuestros días. La sociedad reclama que es necesario que todos estos progresos se incorporen al sistema de una manera equitativa en tiempo oportuno y que el acceso al mejor tratamiento sea universal, ‘porque cada pequeño avance cuenta.
Madrid, 27 marzo 2024|Fuente: Europa Press | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
mar
28
La SEOM destaca los avances en la medicina de precisión o la inmunoterapia frente al cáncer de colon
 La Sociedad Española de Oncología Médica (SEOM) ha destacado los avances que se han dado en los últimos años en la estrategia terapéutica frente al cáncer colorrectal, gracias a la incorporación de la medicina de precisión, la mayor caracterización de subgrupos de este tipo de cáncer y la inmunoterapia.
La Sociedad Española de Oncología Médica (SEOM) ha destacado los avances que se han dado en los últimos años en la estrategia terapéutica frente al cáncer colorrectal, gracias a la incorporación de la medicina de precisión, la mayor caracterización de subgrupos de este tipo de cáncer y la inmunoterapia.
Asimismo, para la SEOM los programas de cribado que vienen implantando las comunidades autónomas de forma progresiva son básicos para disminuir la mortalidad, estimándose que podrían evitar un tercio de las muertes por cáncer colorrectal y salvar más de 3.600 vidas al año en España.
Coincidiendo con el Día Mundial del Cáncer de Colon que se conmemora el próximo domingo 31 de marzo, dentro de la campaña de comunicación ‘En Oncología, cada avance se escribe en mayúsculas’, la SEOM ha repasado los avances más importantes en cáncer colorrectal que han supuesto que la supervivencia por este tipo de tumor se haya duplicado en los últimos 20 años.
En este sentido, la sociedad señala que el cáncer colorrectal será el tumor más frecuentemente diagnosticado en España en 2024 de forma global con 44.294 nuevos casos -27.009 en varones y 17.285 en mujeres-.
Cuando se desglosa por sexos, es superado por el de próstata en varones -30.316 nuevos casos- y el de mama en mujeres -36.395 nuevos casos. Además, asegura que es una causa muy importante de muerte, ya que, en el año 2022, en varones fue la segunda causa de muerte por tumores por detrás del cáncer de pulmón. En las mujeres supuso la tercera causa de mortalidad por cáncer, por detrás del cáncer de mama y el de pulmón.
La importancia de la detección precoz
El factor pronóstico más relevante en la supervivencia del cáncer colorrectal es el estadio, por lo que la SEOM afirma que los programas de detección precoz son esenciales para detectar y tratar las lesiones premalignas antes de que se desarrolle el tumor, y también para que el diagnóstico del tumor se realice en estadios precoces.
La supervivencia a los cinco años de los pacientes con cáncer de colon en estadios precoces supera el 90 por ciento, mientras que en estadios más avanzados se sitúa en torno al 50-70 por ciento. Para la SEOM, pese al incremento constante de las perspectivas de supervivencia de los pacientes con cáncer colorrectal avanzado, los resultados están lejos de ser plenamente satisfactorios.
Por ello, apunta que es preciso tener en cuenta que un porcentaje de pacientes no despreciable con metástasis puede curarse, ya que un 20 por ciento de los pacientes a los que se le somete a cirugía de metástasis no muestran signos de enfermedad a los cinco años.
Además, señala que los análisis retrospectivos han mostrado tasas de supervivencia a los cinco años tras la cirugía de las metástasis de hasta un 70 por ciento, ‘lo cual constituye un hito y un gran avance en nuestros días. La sociedad reclama que es necesario que todos estos progresos se incorporen al sistema de una manera equitativa en tiempo oportuno y que el acceso al mejor tratamiento sea universal, ‘porque cada pequeño avance cuenta.
Madrid, 27 marzo 2024|Fuente: Europa Press | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
feb
16
 El estudio, publicado en Science Translational Medicine, fue coordinado por Luis Álvarez Vallina, jefe de la Unidad de Investigación Clínica en Inmunoterapia del Cáncer H12O-CNIO.
El estudio, publicado en Science Translational Medicine, fue coordinado por Luis Álvarez Vallina, jefe de la Unidad de Investigación Clínica en Inmunoterapia del Cáncer H12O-CNIO.
Esta nueva inmunoterapia está basada en las llamadas ‘células puñal’ (células STAb) y aún tiene que superar ensayos clínicos. La inmunoterapia está mejorando ya las opciones de tratamiento en muchos cánceres, pero los grupos de investigación siguen explorando formas de potenciar el sistema inmune del organismo y dirigirlo contra el tumor, ha demostrado ser más efectiva que la inmunoterapia que se emplea ahora de manera preferente.
La nueva inmunoterapia se basa en las llamadas células puñal, por su acrónimo en inglés, células STAb.
Ha sido probada solo en modelos experimentales, por lo que aún debe superar ensayos clínicos (en humanos) y, por tanto, pasarán al menos dos años antes de que llegue a la clínica.
Las células STAb superan a las células CAR-T (terapia de células T con receptores quiméricos de antígenos) en que logran que otras células T del organismo, que no han sido modificadas, también combatan a las células cancerígenas, amplificando así el efecto de la terapia. Además, las células STAb generan memoria inmunológica, lo que podría indicar un control a largo plazo de la enfermedad en los pacientes tratados.
El mieloma múltiple es el segundo cáncer hematológico más común en adultos, solo por detrás de los linfomas. “En los últimos años estos cánceres se están empezando a tratar con inmunoterapia de células CAR-T -explica Luis Álvarez-Vallina-, que han supuesto una mejora sustancial respecto a las herramientas terapéuticas que existían antes. Pero a pesar de ello, y aunque los pacientes tienen ahora supervivencias más prolongadas, se trata de una enfermedad en la una proporción importante de pacientes recae, y son necesarios tratamientos para las recaídas”.
Esta investigación ha comparado este tratamiento con otra inmunoterapia celular basada en las células puñal o STAb-T, y que puede considerarse una evolución de las terapias con células CAR-T. En ambos casos, las células modificadas en el laboratorio reconocen un mismo antígeno, llamado BCMA, que solo está presente en las células tumorales. De esta forma las células modificadas se dirigen y atacan solo a las células de cáncer.
El estudio muestra que las células STAb-T superan a las CAR-T en que logran que otras células T del organismo, que no han sido modificadas, también combatan a las células cancerígenas, amplificando así el efecto de la terapia.
El grupo de investigación aspira a hacer un ensayo clínico en colaboración con el Hospital Universitario 12 de Octubre para tratar a personas con mieloma múltiple con esta nueva inmunoterapia STAb-T.
Ver articulo completo: Díez Alonso L, Falgas A, Arroyo Ródenas J, Romencín P, Martínez A, Gómez Rosel M, et al. Engineered T cells secreting anti-BCMA T cell engagers control multiple myeloma and promote immune memory in vivo. Science Translational Medicine[Internet].2024[citado 15 feb 2024];16(734). DOI: 10.1126/scitranslmed.adg7962
14 febrero 2024| Fuente: EurekAert| Tomado de | Comunicado de prensa
feb
15
 El bloqueo de la molécula TIGIT en los linfocitos T que infiltran el tumor y la estimulación con interleucina-15 potencian la inmunidad frente al adenocarcinoma.
El bloqueo de la molécula TIGIT en los linfocitos T que infiltran el tumor y la estimulación con interleucina-15 potencian la inmunidad frente al adenocarcinoma.
Un nuevo estudio en un modelo de adenocarcinoma de pulmón pone de manifiesto el papel inmunosupresor de la molécula TIGIT en el microambiente tumoral, identificando además un potencial método para restaurar la inmunidad. En experimentos in vitro los investigadores han demostrado que el bloqueo de TIGIT mediante un anticuerpo, en combinación con IL-15, potencia la citotoxicidad frente a las células tumorales, en un efecto sinérgico que pudo ser reproducido in vivo. La acción terapéutica de la IL-15 fue mayor en un modelo tumoral en ratones genéticamente deficientes en TIGIT, según afirma Kejing Tang, científico de la Universidad Sun Yat-sen y codirector del estudio.
El científico prosigue indicando que los hallazgos son consistentes con los resultados de análisis realizados en pacientes, los cuales presentaron mayores niveles circulantes de linfocitos T CD8+ TIGIT+, en comparación con individuos sanos.
En los pacientes, señala Tang, esta población celular fue más frecuente en la región intratumoral que en la peritumoral o en el tejido sano, siendo esta diferencia altamente específica, ya que no fue observada en otras subpoblaciones de linfocitos T. Adicionalmente, en el examen de más de 400 muestras de pacientes, los científicos determinaron que una elevada proporción entre las moléculas TIGIT y CD96, o bien entre TIGIT y CD226, se asocia a una supervivencia global más corta. Tang subraya el valor pronóstico de TIGIT indicando que ni los niveles de CD96 ni los de CD226 en la inmunohistoquímica tumoral exhibieron asociación alguna con la supervivencia.
En contraste, la proporción de TIGIT con respecto a estas moléculas mostró correlaciones adicionales con el tamaño del tumor y el estadio de la enfermedad.
Ver artículo completo: Luo B, Sun Y, Zhan Q, Luo Y, Chen Y, Fu T, et al. Combining TIGIT blockade with IL-15 stimulation is a promising immunotherapy strategy for lung adenocarcinoma. Clin Transl Med[Internet]. 2024[ citado 14 feb 2024]; 14(1): e1553. doi: 10.1002/ctm2.1553. https://pubmed.ncbi.nlm.nih.gov/38279870/
14 febrero 2024 | Fuente: IntraMed | Tomado de | Noticias Médicas | Neumología| Oncología

