dic
31
 El Ministerio de Salud y Protección Social de Colombia pidió hoy a la ciudadanía priorizar la vacunación contra la fiebre amarilla para prevenir la transmisión de esa enfermedad.
El Ministerio de Salud y Protección Social de Colombia pidió hoy a la ciudadanía priorizar la vacunación contra la fiebre amarilla para prevenir la transmisión de esa enfermedad.
En un comunicado apuntó que en lo que va de año se confirmaron 118 casos del padecimiento y 49 fallecidos en 10 departamentos.
Señaló que Tolima es el territorio más afectado pues, desde el inicio del brote en 2024, reporta 121 enfermos con 47 decesos. Asimismo, alertó que entre los días 26 y 27 del mes en curso se confirmaron otros tres diagnósticos y dos de las personas infectadas murieron.
La cartera ministerial comunicó que, ante la situación y en coordinación con la Secretaría de Salud de Tolima, los gerentes de las instituciones prestadoras de salud, entre otras entidades, desarrolla acciones de control de la enfermedad que se centra en la gestión integral de la contingencia.
También se intensifica la vigilancia, la prevención primaria de la transmisión, el manejo integral de casos y la comunicación del riesgo, con el fin de controlar la propagación.
De acuerdo con la comunicación, desde el inicio del brote, los equipos básicos de salud aplicaron cerca de cinco millones de vacunas contra la fiebre amarilla en todo el país, gracias a lo cual se alcanzó una cobertura superior al 95 % en las zonas de alto riesgo.
Según declaró el ministro, Guillermo Jaramillo, el análisis de los casos reportados en el último periodo permitió concluir que las personas afectadas por la enfermedad son aquellas que se negaron a recibir la vacuna o aquellas que se desplazaron a zonas de alto riesgo y no se inmunizaron previamente.
30 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia
dic
30
 Del 15 al 21 de diciembre se registraron en Italia 950 000 nuevos casos de infecciones respiratorias, con lo que este país llegó a los 5,8 millones de contagios por esos virus en la actual temporada, indica hoy un reporte.
Del 15 al 21 de diciembre se registraron en Italia 950 000 nuevos casos de infecciones respiratorias, con lo que este país llegó a los 5,8 millones de contagios por esos virus en la actual temporada, indica hoy un reporte.
La incidencia general de influenza en la población fue de 17,1 casos por cada 1 000 pacientes, frente a los 14,7 de la semana anterior, de acuerdo con el último parte emitido por el Instituto Superior de Sanidad (ISS), sobre la base de datos recogidos por el sistema de monitoreo RespirVirNet.
El grupo de edad más afectado fue el de los niños de 0 a 4 años, algo que resulta habitual, con aproximadamente 50 casos por cada 1 000 pacientes, resaltan los especialistas del ISS.
De las muestras clínicas analizadas, el 44,2% dio positivo para influenza, mientras que se apreció un porcentaje de 3,2 puntos en el caso del Virus Respiratorio Sincitial (VRS) y mientras que 2,1 puntos porcentuales correspondieron al SARS-CoV-2 y al resto para otros virus respiratorios, precisa la nota.
La vigilancia muestra una prevalencia del virus A(H3N2) sobre el virus A(H1N1), tanto en la comunidad como en los hospitales, mientras que los análisis de secuenciación indican que las cepas actualmente circulantes pertenecen a subclados ya presentes en las vacunas estacionales, destaca el texto.
Ante el aumento de casos, el Ministerio de Salud de Italia reafirmó la importancia de la vacunación contra la influenza y la covid-19, especialmente para los grupos de riesgo y las personas mayores de 60 años.
En el documento se enfatiza además que adoptar medidas preventivas, como la higiene de manos y el uso de mascarillas en entornos concurridos, sigue siendo esencial para limitar la propagación de estos virus respiratorios, particularmente durante este período invernal de alta circulación.
29 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia
dic
26
 Especialistas bolivianos detectaron dos casos de la influenza A (H3N2) subclado K, un subtipo del virus de la gripe A altamente contagioso, informó hoy el Ministerio de Salud y Deportes.
Especialistas bolivianos detectaron dos casos de la influenza A (H3N2) subclado K, un subtipo del virus de la gripe A altamente contagioso, informó hoy el Ministerio de Salud y Deportes.
Los enfermos, localizados este martes, son una niña de 6 años de esta capital y un adulto de 52 años de la cercana ciudad de El Alto, añadió la titular de esa cartera, Marcela Flores, quien llamó a evitar aglomeraciones, intensificar las medidas de bioseguridad y reforzar la vacunación, según el diario La Razón.
Las autoridades activaron un cerco epidemiológico en los lugares de residencia de ambos pacientes y recomendaron su aislamiento, junto a medidas de cuarentena para los contactos y personal de salud que los atiende, agregó el periódico.
La ministra Flores advirtió que este virus circula en humanos desde la pandemia de 1968, y recordó que las redes de salud están en alerta para la vigilancia y búsqueda activa de casos.
“Es necesario –recomendó- retomar el uso de barbijo (tapaboca) sobre todo en espacio cerrados, así como al lavado de manos frecuente, y el uso de alcohol en gel en caso de ser necesario”.
La influenza A(H3N2) es un subtipo del virus de la gripe caracterizado por una alta tasa de evolución genética, y, aunque hasta ahora sus secuelas son parecidas a otras variantes, demostró en algunas regiones un adelanto de la temporada habitual de circulación y un aumento significativo de contagios e internaciones.
24 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia
dic
26
 El Ministerio de Salud Pública de Ecuador decidió ampliar la vacunación contra la influenza para toda la población, sin distinción de grupos prioritarios, anunció hoy la vicepresidenta María José Pinto.
El Ministerio de Salud Pública de Ecuador decidió ampliar la vacunación contra la influenza para toda la población, sin distinción de grupos prioritarios, anunció hoy la vicepresidenta María José Pinto.
En un video publicado en sus redes sociales, Pinto, que está a cargo de la cartera de salud, invitó a la ciudadanía a acudir a los centros de salud para inmunizarse de forma gratuita.
“Desde esta fase, cualquier persona puede vacunarse, sin importar si pertenece o no a un grupo prioritario. Prevención es cuidarnos”, señaló la vicemandataria, al informar que las dosis están disponibles para todas las edades.
De acuerdo con el Ministerio, más de 716 000 personas ya están inmunizadas contra la influenza en el país como parte de la campaña que comenzó el domingo 21 de diciembre.
Aunque la cobertura se amplió, las autoridades insisten en que el objetivo principal sigue siendo los grupos prioritarios, entre ellos niños de seis meses a seis años, adultos mayores, mujeres embarazadas, personas con discapacidad y pacientes con enfermedades crónicas. La campaña contra la influenza se extenderá hasta marzo de 2026.
El pasado sábado el Ministerio confirmó la presencia en el país del primer caso de influenza A(H3N2) variante K, correspondiente a un paciente de la región sur.
Ante la presencia de ese y otros virus respiratorios, reiteraron a la población la importancia de mantener medidas preventivas, como el lavado frecuente de manos, el uso de mascarilla en caso de síntomas respiratorios, y ante cualquier signo de alerta, acudir oportunamente a los servicios de salud.
La semana pasada, el Gobierno activó el Comité de Operaciones de Emergencia (COE) para monitorear la gripe A(H3N2), conocida como supergripe, y la circulación de los otros virus respiratorios, que su incremento es común en el país durante los meses de enero y febrero.
Esta situación ocurre mientras Ecuador sufre una crisis en la salud pública, con desabastecimiento de medicamentos e insumos.
24 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia
dic
25
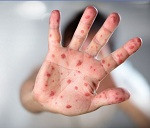 La Secretaría de Salud de México mantiene hoy un llamado a los ciudadanos para que se vacunen contra el sarampión, con más de 5 700 casos confirmados en 2025.
La Secretaría de Salud de México mantiene hoy un llamado a los ciudadanos para que se vacunen contra el sarampión, con más de 5 700 casos confirmados en 2025.
En un video difundido en la red social X, el titular de la cartera, David Kershenobich, recordó que este es uno de los padecimientos más contagiosos, pues basta un solo enfermo “para desencadenar brotes que ponen en riesgo a niños, adolescentes y adultos” no inmunizados.
Señaló que tanto en esta nación norteamericana como en el mundo se ha demostrado que la vacunación constituye la herramienta más efectiva para prevenir la transmisión, evitar complicaciones y proteger a las comunidades.
“Vacunarse no es solo un acto de protección personal, es un acto de responsabilidad colectiva. Cada dosis aplicada contribuye a cerrar las puertas al virus”, sostuvo el secretario al referir que gracias a esto la nación ha logrado controlar la enfermedad durante décadas.
“Pero ese logro –advirtió- requiere mantenerse y reforzarse ante los brotes que se presentan actualmente”.
La Secretaría de Salud recalcó que los inyectables son seguros, gratuitos y están disponibles en todas las unidades de salud.
El sarampión se caracteriza por síntomas como fiebre, conjuntivitis, coriza, tos y erupción cutánea.
Según la información oficial, totalizan 24 las defunciones por esta causa en el país, distribuidas en los estados de Chihuahua (21), Durango (1), Sonora (1) y Jalisco (1), y ninguno de los pacientes contaba con antecedente de vacunación.
23 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia
dic
24
 Del 8 al 14 de diciembre Italia registró 817 000 nuevos casos de infecciones respiratorias agudas, con una tasa de 14,7 contagiados por cada 1 000 pacientes, superior a los 12,7 reportados la semana previa, señala hoy una nota.
Del 8 al 14 de diciembre Italia registró 817 000 nuevos casos de infecciones respiratorias agudas, con una tasa de 14,7 contagiados por cada 1 000 pacientes, superior a los 12,7 reportados la semana previa, señala hoy una nota.
En el más reciente parte emitido por el Instituto Superior de Sanidad (ISS), publicado este domingo en el sitio digital informativo del canal televisivo RAI News, se señala que la mayor incidencia se sigue observando en el grupo de edad de 0 a 4 años, con aproximadamente 42 casos por cada 1 000 pacientes.
El análisis, basado en los datos aportados por la RespiVirNet, red de vigilancia contra los virus respiratorios del ISS, muestra que en este año, desde el inicio de los controles, la cantidad de infectados por los mismos en esta nación europea asciende a 4,9 millones de personas.
En la última semana evaluada, se registró en el flujo comunitario una alta tasa de positividad para influenza, la cual alcanzó los 36,0 puntos porcentuales, muy superior a la de los siete días previos, cuando el porcentaje llegó a 25,3 puntos a la vez que, en el ámbito hospitalario, pasó del 28,8 al 40,4 % , precisa el reporte.
El informe RespiVirNet apunta que “en la comunidad y en el flujo hospitalario, el porcentaje de virus A H3N2 es significativamente superior al de virus A H1N1”, y aclara que “hasta la fecha, no se ha encontrado ninguna muestra positiva para la gripe tipo A no subclasificable como estacional”, indicativas de cepas aviares.
“Los análisis de secuenciación realizados en el gen HA de los virus de la gripe A H3N2 que circulan actualmente en Italia ponen de relieve que, dentro del clado más amplio 2a.3a.1, el subclado K prevalece claramente”, indica el documento.
Sin embargo, “los datos epidemiológicos disponibles hasta ahora indican que no se ha observado ningún aumento en la gravedad de las manifestaciones clínicas”, aclara el ISS en su última notificación sobre el avance de los virus respiratorios en este país.
La intensidad de las infecciones es muy alta en las regiones italianas de Campania y Cerdeña; es alta en Sicilia; muestra valores medios en Abruzos, Emilia-Romaña, Véneto, Lombardía, Piamonte y Valle de Aosta, mientras es relativamente baja en todas las demás zonas del país, agrega la fuente.
21 diciembre 2025 | Fuente: Prensa Latina | Tomado de | Noticia

