jul
4
 Los tumores se situaron por segundo año consecutivo como primera causa de muerte en 2024 en España, con un 26,6% del total de defunciones, seguidos de las enfermedades del sistema circulatorio, que causaron el 26,1% de las muertes, según los datos del Instituto Nacional de Estadística (INE) publicados este lunes.
Los tumores se situaron por segundo año consecutivo como primera causa de muerte en 2024 en España, con un 26,6% del total de defunciones, seguidos de las enfermedades del sistema circulatorio, que causaron el 26,1% de las muertes, según los datos del Instituto Nacional de Estadística (INE) publicados este lunes.
Respecto al año anterior, los fallecimientos por tumores se mantuvieron, mientras que los de enfermedades del sistema circulatorio bajaron un 2,4%. Este descenso implicó que la tasa de muerte por tumores (236,4 por 100 000 habitantes) fuera superior a la de las enfermedades del sistema circulatorio (231,8 por cada 100 000).
En 2024 se produjeron en España 433 357 defunciones: 218 746 de los fallecidos fueron hombres y 214 801 fueron mujeres. El 95,8% de las muertes sucedieron por causas naturales y el 4,2% por causas externas.
Tumores en bronquios y pulmones, los más frecuentes
A nivel más detallado, entre los tumores, el cáncer de bronquios y pulmón fue la causa más frecuente (con 23 239 defunciones, un 1,9% más que en 2023), seguido del cáncer de colon (10 434 fallecidos, un 4,6% menos).
Por su parte, entre las muertes por enfermedades del sistema circulatorio, las enfermedades isquémicas del corazón fueron la causa más frecuente el año pasado, con 26 851 personas fallecidas, un 3,2% menos que en 2023. Por detrás se situaron las enfermedades cerebrovasculares, con 22 786 defunciones (un 2,7% menos).
En las enfermedades más frecuentes, los mayores aumentos de muertes se dieron en la insuficiencia renal (un 10,3 % más) y en la neumonía (7,7%). Por el contrario, las que más descendieron fueron el cáncer de colon y la diabetes mellitus.
Por primera vez desde su aparición en 2020, la covid-19 no figuró en 2024 entre las 15 principales causas de defunción en España, pese a que en el periodo comprendido entre 2020 y 2022 fue la causa más frecuente.
Las mujeres mueren más de demencia
Por sexo, entre las mujeres las causas más frecuentes de muerte fueron la demencia (14 769 fallecidas), las enfermedades cerebrovasculares (12 655) y la insuficiencia cardíaca (11 060).
A los hombres les afectaron más las enfermedades isquémicas del corazón, que causaron 16 892 fallecidos, el cáncer de bronquios y pulmón (16 560 decesos) y las enfermedades cerebrovasculares (10 131).
Fallecimientos por causas externas
En el año 2024 se produjeron 18 304 fallecimientos por causas externas, 271 más que en el año anterior (1,5 %). Por sexo, fallecieron 11 531 hombres (un 0,6 % más que en 2023) y 6 773 mujeres (un 3,1 % más).
La primera causa, por segundo año consecutivo, fueron las caídas accidentales, con 4 407 fallecidos (un 6% más que en 2023), mientras que la segunda fueron los suicidios, con 3 846, una cifra que desciende un 6,6 % con respecto al año anterior.
El suicidio, de hecho, fue la causa de muerte más frecuente entre los hombres, causando 2 834 fallecidos. En las mujeres lo fueron las caídas accidentales, con 2 038 fallecidas, seguidas por el ahogamiento, la sumersión y la sofocación, con 1 736.
Datos por regiones
Atendiendo a las principales causas de muerte, los mayores aumentos de defunciones por tumores se registraron en la ciudad autónoma de Ceuta (con un incremento del 10,2%), Navarra (7,4%) y Asturias (6,6%). Por el contrario, los mayores descensos se dieron en La Rioja (con una bajada del 2,4%), Galicia (2,3%) y Aragón (1,8%).
Por enfermedades del sistema circulatorio, el aumento de decesos más elevado se registró en Baleares (9,2%), Galicia (1,9%) y País Vasco (0,8%). Los mayores descensos ocurrieron en las ciudades autónomas de Melilla (14,9%) y Ceuta (9,4%), y en Canarias (8,5%).
La Rioja presentó el mayor aumento de defunciones por enfermedades respiratorias, creciendo éstas un 44,2%, seguida de Castilla y León (14,1%) y el País Vasco (13,5%).
23 junio 2025 | Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2025. Agencia Informativa Latinoamericana Prensa Latina S.A. | Noticia
abr
4
 El ejercicio físico tiene numerosos beneficios para la salud como que reduce el riesgo de padecer cáncer así como aumenta la capacidad del cuerpo para soportar los tratamientos de quimioterapia y radioterapia e, incluso, en algunos pacientes que realizan actividad física se obtienen mejores resultados que en los que no hacen deporte, según ha aseverado el presidente de la Sociedad Española de Oncología Médica (SEOM), César Rodríguez, durante la jornada ‘Caminando hacia la esperanza: mujer, deporte y cáncer, organizada por GSK y la Liga F.
El ejercicio físico tiene numerosos beneficios para la salud como que reduce el riesgo de padecer cáncer así como aumenta la capacidad del cuerpo para soportar los tratamientos de quimioterapia y radioterapia e, incluso, en algunos pacientes que realizan actividad física se obtienen mejores resultados que en los que no hacen deporte, según ha aseverado el presidente de la Sociedad Española de Oncología Médica (SEOM), César Rodríguez, durante la jornada ‘Caminando hacia la esperanza: mujer, deporte y cáncer, organizada por GSK y la Liga F.
En el contexto del cáncer, existen factores de riesgo evitables y están relacionados con los hábitos de vida, y otros que no se pueden evitar debido a factores hereditarios. Adoptar un estilo de vida saludable como el deporte puede reducir la mortalidad un 30 por ciento y hasta un 20 por ciento la incidencia, ha aseverado el presidente de SEOM.
Asimismo, el experto ha asegurado que, en un paciente realiza ejercicio físico antes y durante el tratamiento de un cáncer hay menos complicaciones postoperatorias’ ya que los programas de ejercicio físico antes de la cirugía permiten preparar mejor al paciente.
Ya tenemos estudios que dicen que las mujeres que realizan ejercicio físico en tratamiento con quimioterapia tienen mayor tasa de respuesta’, ha añadido. No obstante, ha advertido de que ‘no vale cualquier ejercicio físico’ sino que ‘hay que derivar a programas bien estructurados con una evaluación previa del paciente’, para lo que es necesario fomentar la formación de los profesionales sanitarios en este ámbito. Otro punto esencial es la formación adecuada de los profesionales que vayan a hacer ejercicio físico con los pacientes con cáncer.
Todo lo que está relacionado con ejercicio físico en Oncología no es tarea del oncólogo, hay que contar con Atención Primaria, Enfermería, especialistas en deporte, y otra labor de los terapeutas ocupacionales y psico oncólogos, ha explicado.
Un ejemplo de los beneficios que puede llegar a tener el deporte en un diagnóstico de cáncer es el caso de la exjugadora del Atlético de Madrid, Virginia Torrecilla, que fue diagnosticada de un tumor cerebral en el año 2020 y que, gracias a los tratamientos y al deporte ha podido superar con éxito.
El deporte me ayudó mucho, cuando entré en quirófano lo primero que me dijo mi oncóloga es que gracias al deporte tengo un cuerpo muy bueno para soportar las quimioterapias y las radioterapias. Me dijeron que si no hubiese sido deportista la quimioterapia me hubiese comido.
Lo asumí bastante bien gracias al deporte porque mientras estaba en quimioterapia cada vez que llegaba a casa hacía deporte. Para mí el deporte siempre ha sido vida, fue lo que me hizo estar a día de hoy aquí’, ha declarado Torrecilla. Así, la exfutbolista ha recalcado que ‘el deporte es vida’ porque ‘es cuidarte contigo mismo’ y que, por ello, hay que ‘meterlo en la vida para siempre y no solo en los momentos malos o enfermedades’.
Esto no quiere decir que no vayamos a enfermar, pero lo más importante es que nos cuidemos para el día a día y afrontarlo de la mejor manera y creo que el deporte hace eso’, ha afirmado. El deporta ha acompañado a Virginia durante toda su vida, pero más aún en los momentos más duros de su enfermedad donde, aunque su cuerpo ‘no reaccionaba’, ella intentaba sacar fuerzas para ‘hacer sentadillas’ en el hospital.
Estaba muy delgada, adelgacé 17 kilogramos y no tenía fuerza, pero con las pesas intentaba hacer sentadillas. Yo lo intentaba y eso me hacía estar bien, pero los últimos tres meses que me quedaban tres sesiones de quimioterapia fueron horribles, me quedaba en cama, en el hospital, estaba muy débil, pero aun así me levantaba de la cama y me ponía a hacer sentadillas. Esos momentos fueron muy duros porque me di cuenta de que mi cuerpo ya no reaccionaba’, ha detallado la deportista.
En este sentido, el secretario de la Asociación de pacientes de Cáncer de Mama y Ovario Hereditario (AMOH), Marcelo Ruiz, ha recalcado que, aunque se sabe que ‘el ejercicio físico es bueno’, hay que recordar que ‘no cura el cáncer, pero sí que ayuda.
Proyecto mujer, deporte y cáncer
Con el fin de promover los beneficios del ejercicio físico para el cáncer, AMOH ha desarrollado, en colaboración con diferentes sociedades científicas, GSK y BMS, el proyecto ‘Mujer, deporte y cáncer’. El abandono deportivo es mayor en la mujer que en el hombre, la clave está en la educación, creemos y apostamos enormemente porque sea la sociedad científica la que difunda este mensaje, porque tiene un altavoz increíble’, ha señalado Marcelo Ruiz.
Además, GSK y Liga F firmaron en julio de 2023 un acuerdo de colaboración y patrocinio que tiene como objetivo impulsar el papel de la mujer en el deporte y, a la vez, ayudar a promocionar un estilo de vida saludable entre las mujeres.
El acuerdo firmado parte del vínculo entre la salud y el deporte como pilares fundamentales de un estilo de vida saludable. Durante la jornada también se ha presentado el documental ‘Caminando hacia la esperanza’, realizado por GSK, en el que se narra el trayecto de 21 kilómetros de unas pacientes de cáncer en Tenerife que cuentan su testimonio tras haber superado el cáncer porque ‘del cáncer se sale.
3 abril 2024|Fuente: Europa Press| Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
mar
26
 Médicos y pacientes de cáncer de pulmón han reclamado integrar la sexualidad en la consulta oncológica para conocer los efectos que la enfermedad y los tratamientos tienen en su sexualidad y, en el caso de las mujeres, han pedido información que vaya más allá de la maternidad.
Médicos y pacientes de cáncer de pulmón han reclamado integrar la sexualidad en la consulta oncológica para conocer los efectos que la enfermedad y los tratamientos tienen en su sexualidad y, en el caso de las mujeres, han pedido información que vaya más allá de la maternidad.
Así lo ha expresado la Asociación de Afectados de Cáncer de Pulmón (AEACaP) que ha presentado este jueves la segunda edición del proyecto ‘A Pulmón’ para visibilizar el cáncer ‘y convivir con la enfermedad de manera diferente, rompiendo estigmas y afrontando retos, como el montañismo’.
En el acto, el coordinador médico de ‘A pulmón’, Santiago Viteri, ha resaltado la importancia de integrar la sexualidad en los procesos oncológicos, ‘un aspecto de la vida y la salud del paciente que muchas veces no se explora por falta de tiempo o tabú social’.
El impulsor de la iniciativa, Alberto Urtasun, ha incidido en la situación de las mujeres con cáncer, quienes ven limitado el seguimiento de su sexualidad a una vigilancia de la fertilidad, y ha afirmado que los oncólogos deberían ofrecer información sobre los efectos secundarios que tienen los tratamientos sobre aspectos como la sensibilidad sensorial, la lubricación o los niveles hormonales de las afectadas.
Pacientes como Teresa han reivindicado un cambio en la atención oncológica en lo referente a sexualidad y ha lamentado que la preocupación se centre en si podrán o no tener hijos.
El sexo forma parte de nuestras vidas y tendríamos que darle cancha libre en el tratamiento médico’, señala Vanesa, paciente que logró escalar el Pico de Sotllo del Pirineo catalán tan solo 90 después de su operación.
Esta reivindicación forma parte del objetivo de la AEACaP de mejorar la calidad de vida de los pacientes de cáncer de pulmón, un diagnóstico que era desfavorable en la mayoría de los casos, pero que gracias a la investigación cada vez tiene más supervivencia.
Así, el estigma que recae sobre el paciente es una barrera que le impide desarrollar su vida con la mayor normalidad posible, con independencia de la edad, el diagnóstico y el pronóstico que tenga.
Por ello, uno de los oncólogos participantes del proyecto ‘A pulmón’, Fabio Franco, ha expresado la importancia de ‘quitar la mesa entre el paciente y el médico’ y de impulsar iniciativas que permitan a los pacientes ‘compartir su propia experiencia’ y ‘contagiarse de esta visión de la vida y de la enfermedad’.
Si puedo subir una montaña podré superar muchos más retos. (…) Los pacientes no somos tan pacientes, no somos enfermos. La calidad de vida no la podemos perder, la tenemos que cuidar’, comenta Vanesa.
Madrid, 21 marzo 2024|Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A
mar
23
 El cáncer puede transmitirse a receptores inmunosuprimidos cuando se trasplantan órganos de donantes con neoplasias, pero un programa del Hospital Virgen de la Arrixaca de Murcia ha demostrado que, aunque no existe el riesgo cero, en el los tumores del sistema nervioso central son más los beneficios.
El cáncer puede transmitirse a receptores inmunosuprimidos cuando se trasplantan órganos de donantes con neoplasias, pero un programa del Hospital Virgen de la Arrixaca de Murcia ha demostrado que, aunque no existe el riesgo cero, en el los tumores del sistema nervioso central son más los beneficios.
Desde que lo pusiera en marcha en 2021, este hospital ha tenido hasta hoy 25 donantes reales con un tumor cerebral o en la médula ósea (21 en asistolia, es decir, en parada cardiaca, y 4 en muerte encefálica), gracias a los cuales se han hecho 19 trasplantes de hígado, 14 de riñón y 5 de corazón a 38 receptores. Así lo ha explicado Mario Royo-Villanova, coordinador de trasplantes del hospital murciano, en la XIX Reunión Nacional de Coordinadores de Trasplantes y profesionales de la comunicación que concluye este viernes en Toledo.
Todo empezó de manera ‘emocional’ cuando el padre de un oncólogo joven del hospital, diagnosticado con un tumor cerebral muy maligno y agresivo manifestó su deseo de donar sus órganos. Se estima que aproximadamente el 0,05 % de los receptores desarrollan un cáncer transmitido por el donante, pero la probabilidad se reduce con una adecuada evaluación y selección del donante, según el Documento de consenso sobre la evaluación del donante de órganos para prevenir la transmisión de enfermedades tumorales.
En un país en el que los donantes tienen una edad avanzada, en los que la probabilidad de padecer cáncer es mayor, puede aumentar el riesgo de transmitir un cáncer oculto, pero el incremento del número de pacientes en lista de espera, junto a la escasez de órganos disponibles, hacen necesario reconsiderar los criterios de aceptación de órganos de personas con una historia previa o actual de cáncer.
Así que en el hospital se pusieron a estudiar la literatura científica y a valorar el riesgo beneficio de realizar un trasplante a partir de este paciente con un glioblastoma. De esta forma, a partir de datos de datos de autopsias, comprobaron que la posibilidad de metástasis en pacientes con tumores del sistema nervioso central es muy baja; donde más alta es el riesgo de transmisión es en pulmón, seguido de los ganglios linfáticos, hueso, hígado, y riñón. En corazón no aparecía un solo caso.
Lo que empezamos a valorar es que el riesgo probablemente sobrepase con mucho el beneficio al riesgo, y así empezamos a funcionar’, resume. Hoy, ‘el programa está funcionando relativamente bien’, aunque ‘es verdad que el potencial podría ser más alto, pero es difícil que, desde el principio, el programa esté tan depurado y tan pulido’. Aunque en otros lugares del mundo se ha hecho este tipo de intervenciones de manera esporádica, este hospital sí que es el primero en tener un programa ‘muy regulado y estructurado’. Por ahora, en el Virgen de la Arrixaca no se ha notificado ningún caso de transmisión, aunque son conscientes de que ‘con el tiempo y con el desarrollo del proyecto, llegará un día en que pueda haber una’, ha admitido Royo-Villanova. Cuando eso ocurra, actuarán ‘inmediatamente’, probablemente sustituyendo el órgano afectado por otro. ‘Pero es cierto que el riesgo cero nunca existe’, ha admitido.
El coordinador de trasplantes de este hospital ha mostrado su convencimiento de que otros centros españoles se irán adhiriendo a su proyecto, lo cual permitirá cuantificar con mayor precisión ese riesgo, algo por ahora imposible, y poder decir que ‘en corazón es cero, en riñón 1 de 400, en el hígado 1 de 300 y en el pulmón 1 de 100′. Aunque tendrá que ser la Organización Nacional de Trasplantes (ONT) la que lidere, organice y coordine la iniciativa, opina.
Toledo, 22 marzo 2024|Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
mar
16
 Científicos brasileños descubrieron una bacteria en el suelo de la Amazonía que produce un compuesto con propiedades antitumorales similares a las de la quimioterapia, lo que podría ayudar a luchar contra el cáncer de mama y otras enfermedades, informaron este jueves los responsables del estudio. La bacteria ‘Pseudomonas aeruginosa’, que se encuentra en el suelo del estado amazónico de Pará, genera un compuesto que resultó ser capaz de reducir al 50 % la capacidad de las células cancerosas para crecer y multiplicarse en 72 horas, según el estudio, publicado en la revista ‘Scientific Reports‘.
Científicos brasileños descubrieron una bacteria en el suelo de la Amazonía que produce un compuesto con propiedades antitumorales similares a las de la quimioterapia, lo que podría ayudar a luchar contra el cáncer de mama y otras enfermedades, informaron este jueves los responsables del estudio. La bacteria ‘Pseudomonas aeruginosa’, que se encuentra en el suelo del estado amazónico de Pará, genera un compuesto que resultó ser capaz de reducir al 50 % la capacidad de las células cancerosas para crecer y multiplicarse en 72 horas, según el estudio, publicado en la revista ‘Scientific Reports‘.
Este resultado es comparable a los obtenidos por los tratamientos convencionales con quimioterapia, según afirmaron los científicos en un comunicado divulgado por el Instituto Vale de Tecnología y por la Universidad Federal del Sur y Sudeste de Pará. La sustancia también demostró resultados prometedores en la lucha contra otras bacterias y virus de interés veterinario y médico, como el herpes o el coronavirus murino, que infecta a los ratones, según el comunicado. De acuerdo con uno de los autores del estudio, Sidnei Cerqueira, el compuesto descubierto puede servir para inhibir la toxicidad en suelos contaminados por metales pesados. Otro de los autores, José Pires, señaló el suelo amazónico como un lugar propicio para el desarrollo de diferentes bacterias con gran ‘interés farmacéutico’.
Ver artículo: Cerqueira dos Santos S, Araújo Torquado C, Alexandria Santos D de, Orsato A, Leite K, Mara Serpeloni J, et al. Production and characterization of rhamnolipids by Pseudomonas aeruginosa isolated in the Amazon region, and potential antiviral, antitumor, and antimicrobial activity. Scientific Reports[Internet].2024[citado 15 mar 2024]; 4629. https://doi.org/10.1038/s41598-024-54828-w
14 marzo 2024 | Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A
feb
15
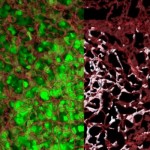
 El bloqueo de la molécula TIGIT en los linfocitos T que infiltran el tumor y la estimulación con interleucina-15 potencian la inmunidad frente al adenocarcinoma.
El bloqueo de la molécula TIGIT en los linfocitos T que infiltran el tumor y la estimulación con interleucina-15 potencian la inmunidad frente al adenocarcinoma.
Un nuevo estudio en un modelo de adenocarcinoma de pulmón pone de manifiesto el papel inmunosupresor de la molécula TIGIT en el microambiente tumoral, identificando además un potencial método para restaurar la inmunidad. En experimentos in vitro los investigadores han demostrado que el bloqueo de TIGIT mediante un anticuerpo, en combinación con IL-15, potencia la citotoxicidad frente a las células tumorales, en un efecto sinérgico que pudo ser reproducido in vivo. La acción terapéutica de la IL-15 fue mayor en un modelo tumoral en ratones genéticamente deficientes en TIGIT, según afirma Kejing Tang, científico de la Universidad Sun Yat-sen y codirector del estudio.
El científico prosigue indicando que los hallazgos son consistentes con los resultados de análisis realizados en pacientes, los cuales presentaron mayores niveles circulantes de linfocitos T CD8+ TIGIT+, en comparación con individuos sanos.
En los pacientes, señala Tang, esta población celular fue más frecuente en la región intratumoral que en la peritumoral o en el tejido sano, siendo esta diferencia altamente específica, ya que no fue observada en otras subpoblaciones de linfocitos T. Adicionalmente, en el examen de más de 400 muestras de pacientes, los científicos determinaron que una elevada proporción entre las moléculas TIGIT y CD96, o bien entre TIGIT y CD226, se asocia a una supervivencia global más corta. Tang subraya el valor pronóstico de TIGIT indicando que ni los niveles de CD96 ni los de CD226 en la inmunohistoquímica tumoral exhibieron asociación alguna con la supervivencia.
En contraste, la proporción de TIGIT con respecto a estas moléculas mostró correlaciones adicionales con el tamaño del tumor y el estadio de la enfermedad.
Ver artículo completo: Luo B, Sun Y, Zhan Q, Luo Y, Chen Y, Fu T, et al. Combining TIGIT blockade with IL-15 stimulation is a promising immunotherapy strategy for lung adenocarcinoma. Clin Transl Med[Internet]. 2024[ citado 14 feb 2024]; 14(1): e1553. doi: 10.1002/ctm2.1553. https://pubmed.ncbi.nlm.nih.gov/38279870/
14 febrero 2024 | Fuente: IntraMed | Tomado de | Noticias Médicas | Neumología| Oncología

