may
1
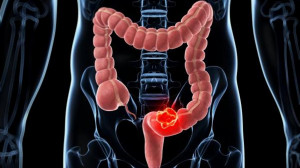
El tumor de Wilms -también conocido como nefroblastoma- es el más frecuente en el cáncer de riñón infantil. Investigadores del Hospital Infantil de Los Ángeles han identificado una alteración en el desarrollo temprano de las células progenitoras renales que puede estar relacionada con la formación del tumor de Wilms.
En un estudio publicado en Advanced Science, investigadores del Laboratorio GOFARR de Urología compararon células progenitoras renales de un tumor con células precursoras de un riñón sano. Normalmente, estas células precursoras maduran hasta convertirse en células renales, pero cuando su desarrollo temprano está desregulado, se comportan como células madre cancerosas.
Aunque la mayoría de los niños con tumor de Wilms son tratados con éxito, las terapias actuales son agresivas. Una minoría de estos pacientes presenta pronósticos desfavorables o recaídas; para estos niños no existe ninguna terapia. «Al lograr una comprensión más precisa de cómo se desarrollan los tumores de Wilms, nuestro objetivo es encontrar nuevos tratamientos para todos los tipos de tumor de Wilms», afirma la doctora Laura Perin, codirectora del laboratorio GOFARR y coautora principal del estudio junto con el doctor Stefano Da Sacco, otro investigador del laboratorio GOFARR.
En lugar de convertirse en células renales, se convierten en células tumorales
«El tumor de Wilms pediátrico puede considerarse un cáncer del desarrollo», afirma el Dr. Perin, que también es profesor asociado de la Facultad de Medicina Keck de la USC. «El riñón adulto normal carece de células precursoras renales, ya que éstas se ‘agotan’ antes del nacimiento. Pero en los tumores de Wilms, en lugar de dar lugar a un riñón funcional, estas células precursoras persisten y forman la masa tumoral.» Los investigadores caracterizaron estas células precursoras del riñón del tumor de Wilms y descubrieron que estas células pueden reproducir el tumor original.
«Son agresivas, resistentes a los fármacos, metastatizan como células cancerosas y son capaces de crear el tumor completo que vemos en los pacientes», afirma el doctor Astgik Petrosyan, investigador del laboratorio GOFARR y primer autor del estudio.
Células ajenas a las señales de crecimiento
Las células precursoras del riñón que generan los tumores de Wilms también expresaban anormalmente ITGβ1 e ITGβ4, proteínas que ayudan a las células a comunicarse con su microentorno. «Esta unión anormal a su microentorno favorece la replicación descontrolada de estas células y guía la formación de la masa tumoral», afirma el Dr. Da Sacco.
«Nuestros hallazgos proporcionan una comprensión más precisa de las diferentes etapas del desarrollo renal, tanto normal como anormal», afirma el Dr. Perin. «Esto puede ayudar posiblemente al diagnóstico del tumor de Wilms, lo que conduciría a tratamientos más eficaces para estos pacientes».
Mayo, 01/2023 (MedicalXpress) – Tomado de Oncology & Cancer – Pediatrics Copyright Medical Xpress 2011 – 2023 powered by Science X Network.
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
29
Entre el 60 y el 70% de los pacientes con cáncer de colon y recto avanzado reciben quimioterapia basada en el platino, pero la mitad de los tumores tienen la capacidad de generar resistencia en este abordaje.
En este contexto, un estudio en pacientes y modelos preclínicos de cáncer de colon y recto del Instituto Hospital del Mar de Investigaciones Médicas (IMIM-Hospital del Mar), con participación del Instituto de Investigación Sanitaria INCLIVA, el Institut Català d’Oncologia (ICO), el Vall d’Hebron Institut d’Oncologia (VHIO), el Institut de Recerca Biomèdica (IRB) de Barcelona, la Universidad de Oviedo y el CIBER del cáncer (CIBERONC), ha revelado que el oxaliplatino se acumula en las células sanas que rodean las células cancerosas y, como consecuencia, pueden hacer disminuir la sensibilidad del cáncer en el tratamiento.
El trabajo, publicado en la revista Nature Communications, destaca el protagonismo de las células no cancerosas en la respuesta a la terapia y abre la puerta a una estrategia de oncología de precisión basada en la diversidad de mecanismos de sensibilidad y una acción más personalizada.
En este trabajo, que ha contado con el apoyo del Instituto de Salud Carlos III y la Asociación Española Contra el Cáncer (TuMICC project, Junior Clinician Fellowship), los investigadores han analizado muestras de 30 pacientes con cáncer de colon y recto avanzado -antes y después de someterse a quimioterapia-, validando los resultados en modelos de ratón. Para hacerlo, se han utilizado técnicas desarrolladas en el campo de la geología aplicadas a las muestras biológicas.
Según explican Alexandre Calon, jefe del Laboratorio de Investigación traslacional en microambiente tumoral del IMIM-Hospital del Mar y líder del estudio, y Jenniffer Linares, primera autora del estudio y miembro del citado laboratorio, «se analizó la acumulación de platino en tejidos tumorales de pacientes e in vitro, en células cancerosas y sanas derivadas de pacientes».
En concreto, mediante la técnica LA-ICP-MS (Laser Ablation Inductively Coupled Plasma Mass Spectrometry) -utilizada en geología y que permite identificar la localización espacial de diferentes metales, incluido el platino-, «se estudiaron muestras tumorales parafinadas de pacientes con cáncer de colon y recto que recibieron tratamiento con quimioterapia basada en platino». Paralelamente, señalan los investigadores, se realizó ICP-MS (inductively coupled plasma-mass-spectrometry) en células cancerosas y sanas provenientes de tumores de colon para comprobar la absorción de platino al nivel celular.
Con este trabajo, apuntan Linares y Calon, «se ha podido comprobar que el platino se acumula de forma muy destacada en las células sanas que rodean al tumor, en especial en los fibroblastos, las células que contribuyen a la creación de tejidos». Además, esta acumulación se mantiene durante largos periodos de tiempo, «más de dos años después de la finalización del tratamiento».
Dos años posteriores tras el tratamiento
Tras analizarse muestras de cáncer de colon que habían sido obtenidas en diferentes tiempos después del tratamiento con platino, se observó que el patrón de acumulación de este fármaco en las células sanas se reproducía en todas las muestras analizadas, encontrándose hasta 2 años después de haberse finalizado el tratamiento.
Esta acumulación genera, a su vez, la activación de determinados genes vinculados a una mala respuesta al tratamiento con quimioterapia y a la progresión tumoral, y asociados a la activación de la vía de TGF-β en los fibroblastos, «los cuales una vez activados estimulan a las células tumorales que han sobrevivido a la quimioterapia a progresar de nuevo».
Según Calon, «la activación de los fibroblastos por el oxaliplatino puede generar mecanismos de resistencia a la misma quimioterapia». Respecto a si son los resultados esperados, Linares y Calon apuntan que «por muchos años la investigación de la resistencia a los tratamientos oncológicos se ha enfocado en el estudio de las células cancerosas. El hecho de observar una mayor acumulación del oxaliplatino en células no cancerosas es sorprendente y destaca la importancia de las células sanas que están dentro del tumor, específicamente de los fibroblastos asociados al cáncer, como causantes de la progresión tumoral y la resistencia a la quimioterapia».
Actualmente, no se dispone de marcadores predictivos de respuesta a la quimioterapia en cáncer de colon y recto. Sin embargo, el trabajo ha permitido comprobar que los niveles de otra proteína, la periostina en muestras de pacientes con cáncer de colon son un indicador de actividad de TGF-β en los fibroblastos y funcionan como un buen marcador de resistencia a la quimioterapia basada en platino.
Así, la respuesta a la quimioterapia era mala en aquellas personas en las que los niveles de periostina eran elevados antes de recibir las primeras dosis o en aquellos que eran bajos, pero se disparaban después del tratamiento. Asimismo, se comprobó que en los modelos de ratón que tenían niveles más altos de esta proteína, el tratamiento contra el tumor pierde efectividad.
Linares destaca que «hemos descubierto un mecanismo de resistencia al oxaliplatino y un marcador de esta resistencia en pacientes con cáncer de colon y recto». Un hecho que demuestra, según Calon, que hay que tener en cuenta el entorno del tumor a la hora de desarrollar los tratamientos contra el cáncer. «Las quimioterapias se evalúan en relación con su efectividad sobre las células cancerosas, no sobre las células sanas que forman el microambiente tumoral, que protege al tumor». Para Clara Montagut, jefa de sección de tumores gastrointestinales del Hospital del Mar e investigadora del CiberONC, este estudio es un paso importante para entender por qué el tratamiento de quimioterapia no funciona igual en todos los pacientes con cáncer, y poder prevenir o revertir la resistencia a la quimioterapia.
El siguiente paso crítico será desarrollar estrategias farmacológicas que actúen sobre la célula cancerosa y modulen el microambiente a favor de la eliminación del tumor».
Abril 29/2023 (Diario Médico) – Tomado de Oncología – Novedosos datos en ‘Nature Communication’ Copyright Junio 2018 Unidad Editorial Revistas, S.L.U.
abr
27
En un descubrimiento que podría mejorar la supervivencia de los pacientes con cáncer de vejiga, científicos de Northwestern Medicine han desarrollado una prueba de firma de biomarcadores para predecir qué tumores responderán a la inmunoterapia.
Los fármacos de inmunoterapia de punto de control, que activan el sistema inmunitario del organismo para que reconozca un tumor, sólo son eficaces en un 20% de los casos de cáncer de vejiga. Pero los clínicos desconocen qué pacientes se beneficiarán y por qué no son más eficaces para todos.
En el nuevo estudio -con múltiples colaboradores internacionales- los investigadores de la Facultad de Medicina Feinberg de la Universidad Northwestern identificaron tres tipos de tumores que podrían responder a la inmunoterapia y dos que no. Mediante una combinación de perfiles de expresión génica, mutaciones y proteómica espacial, los científicos también analizaron los cánceres que no respondían para identificar posibles nuevos fármacos y terapias que pudieran utilizarse para hacerlos sensibles a la inmunoterapia.
El estudio se publicará el 27 de abril en Nature Communications.
El cáncer de vejiga, suele ser letal y no ha experimentado mejoras en la supervivencia en los últimos 30 años.
«La inmunoterapia ha cambiado la forma de tratar el cáncer de vejiga, pero tiene importantes limitaciones, ya que la mayoría de los pacientes no responden al tratamiento», afirma el Dr. Joshua Meeks, investigador principal, profesor asociado de urología en Feinberg y urólogo de Northwestern Medicine. «A miles de pacientes se les extirpa la vejiga cada año, y tratar a estos pacientes con inmunoterapia podría mejorar la supervivencia y aumentar potencialmente sus posibilidades de conservar la vejiga en lugar de extirpársela quirúrgicamente».
En este estudio, los investigadores comenzaron con un ensayo de fase II de 82 pacientes tratados con Keytruda (una inmunoterapia) antes de la extirpación de la vejiga. Se trataba de un ensayo único que evaluaba el perfil de expresión génica antes y después de Keytruda, con la capacidad de medir completamente la respuesta a Keytruda cuando se extirpaba la vejiga. Normalmente, Keytruda y otras inmunoterapias se utilizan en pacientes con cáncer metastásico, y los cambios biológicos que se producen en el tumor no se pueden monitorizar con biopsias tumorales. Mediante el perfil del transcriptoma, las alteraciones del ADN y los cambios espaciales que se producían en los tumores tratados con Keytruda, los investigadores pudieron identificar qué características se asociaban con la respuesta o la resistencia.
Por ejemplo, un tercio de los tumores pertenecían a un subtipo con muy pocas células inmunitarias infiltradas en el tumor, pero con una mayor expresión de la vía oncogénica regulada por FGFR3 y una nueva red reguladora de genes activados por un regulador epigenético KDM5B. Dirigiéndose al FGFR3 o al KDM5B, los investigadores podrían volver a despertar una respuesta inmunitaria. Dentro de un año se iniciarán en Northwestern Medicine ensayos clínicos con nuevas combinaciones de medicamentos e inmunoterapia para superar la resistencia inmunitaria.
Además, las conclusiones del estudio también proporcionan «un atlas genómico del cáncer más funcional», afirmó Meeks, que también es catedrático de Urología Edward Schaeffer, M.D., Ph.D. y miembro del Centro Oncológico Integral Robert H. Lurie de la Universidad Northwestern. «El atlas genómico actual examina los componentes fundamentales del cáncer de vejiga, pero no describe ningún tratamiento. Eso es lo que hace significativa esta evaluación. Se trata de cómo responde el cáncer de vejiga a la inmunoterapia».
El Atlas del Genoma del Cáncer es un programa de genómica del cáncer del Instituto Nacional del Cáncer que caracterizó molecularmente más de 20.000 cánceres primarios. El autor principal de este trabajo, el Dr. A. Gordon Robertson, fue también investigador principal del atlas genómico del cáncer de vejiga.
Los hallazgos fueron el resultado de múltiples colaboraciones con grupos internacionales que podían realizar ensayos con inmunoterapia que no estaban disponibles en EE.UU. «Gracias a los esfuerzos científicos en equipo, pudimos aprovechar distintos conocimientos especializados y muestras poco comunes de ensayos clínicos para responder a preguntas importantes sobre qué pacientes responderán a la inmunoterapia para el tratamiento del cáncer de vejiga», afirmó Meeks.
Los científicos de Northwestern colaboraron con investigadores clínicos principales de Italia (Dr. Andrea Necchi) y el Reino Unido (Dr. Thomas Powles.) para desarrollar un biomarcador con bioinformáticos de Canadá y Francia (Clarice Groeneveld). A continuación, los investigadores validaron este biomarcador en una tercera cohorte que trataba a pacientes de todo el mundo.
La investigación se financió principalmente con fondos del Polsky Urologic Cancer Institute del Robert H. Lurie Comprehensive Cancer Center de la Northwestern University en el Northwestern Memorial Hospital, la AACR-Bayer Innovation and Discovery Grant, el Departamento de Defensa de EE.UU. y la Veterans Health Administration.
Abril 27/2023 (MedicalXpress) – Tomado de Immunology Copyright Medical Xpress 2011 – 2023 powered by Science X Network.
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
25
Científicos han propuesto una teoría sobre cómo las células cancerosas podrían adaptarse activamente al sistema inmunitario para hacerse resistentes a la inmunoterapia, según informa un estudio publicado hoy (25 de abril) en eLife.
Su teoría sugiere que, a medida que una población de células cancerosas evoluciona y se adapta en respuesta a ser reconocida y destruida por el sistema inmunitario, el reconocimiento inmunitario y las condiciones ambientales determinan la dificultad con la que una futura enfermedad puede ser atacada con un tratamiento diferente.
Los tratamientos que utilizan el propio sistema inmunitario del organismo contra el cáncer (inmunoterapias) prometen una remisión más duradera de la enfermedad. Al atacar las «banderas» moleculares de la superficie de las células tumorales, denominadas antígenos asociados a tumores (AAT), es posible alertar al sistema inmunitario del organismo de su presencia, potencialmente durante muchos años.
Por desgracia, al igual que los tumores encuentran mecanismos compensatorios para adaptarse a la quimioterapia, las células cancerosas también pueden encontrar formas de eludir el reconocimiento del sistema inmunitario. Pero mientras que la resistencia a los fármacos puede ser problemática para las terapias convencionales, cuando las células cancerosas se adaptan para evitar el reconocimiento inmunitario, pierden y ganan TAA, y estos nuevos antígenos podrían ser el objetivo de nuevas inmunoterapias.
«Hasta ahora se suponía que las células cancerosas se adaptaban a ser reconocidas por el sistema inmunitario de forma pasiva, en lugar de percibir el entorno inmunitario circundante y adaptarse activamente», explica Jason George, coautor del estudio y profesor adjunto del Departamento de Ingeniería Biomédica de la Universidad A&M de Texas (EE.UU.).
«Sin embargo, experimentos anteriores han demostrado que el nivel de evasión del cáncer puede ser ajustado con precisión por las células malignas que detectan las tensiones ambientales e inmunológicas. En respuesta al estrés, las células cancerosas pueden adaptarse adquiriendo mutaciones y alterando el nivel de proteínas que de otro modo serían raras, por ejemplo, para sobrevivir. Esto puede dar lugar a cambios en las firmas de antígenos presentes en las células cancerosas que el sistema inmunitario es capaz de reconocer, y el seguimiento de estas modificaciones podría revelar nuevas vulnerabilidades que pueden ser objeto de tratamiento terapéutico».
Bajo la vigilancia del sistema inmunitario humano, las células cancerosas se eliminan, escapan al sistema inmunitario o alcanzan un equilibrio en el que el cáncer coexiste con el sistema inmunitario durante un largo periodo de tiempo. Todos estos resultados dependen de una compleja interacción entre el reconocimiento inmunitario y la evolución del cáncer, y se desconocen en gran medida los efectos resultantes de una estrategia de evasión adaptativa del cáncer sobre la posterior progresión de la enfermedad.
Para abordar esta cuestión, el equipo desarrolló un modelo matemático para cuantificar la agresividad de la estrategia evolutiva de una población de células cancerosas cuando se enfrentan a diferentes entornos inmunitarios.
Como predijeron los autores, las poblaciones de células cancerosas que adoptaban una estrategia de evasión activa superaban a sus homólogas pasivas, lo que aumentaba drásticamente la frecuencia con la que las poblaciones cancerosas acababan escapando del sistema inmunitario. Sin embargo, aunque estas poblaciones evadieron la inmunidad, pagaron una penalización en forma de un mayor número de mutaciones y/o alteraciones transcripcionales, que afectan al perfil TAA general de la población celular.
El modelo también predijo que las células cancerosas en un entorno inmunitario favorable al tumor se volverían inestables porque ganan y pierden AAT, lo que podría explicar por qué los tumores sólidos suelen tener puntos «calientes» y «fríos» que responden o no a la inmunoterapia, respectivamente.
El modelo, denominado Evasión tumoral mediante pérdida adaptativa de antígenos (TEAL), consiste en una población de células cancerosas que son atacadas a lo largo del tiempo por un sistema de reconocimiento, es decir, el sistema inmunitario. Si las células cancerosas utilizan una estrategia pasiva, la población cancerosa no cambia el ritmo al que intenta evadir el sistema inmunitario a lo largo del tiempo. Por el contrario, en una estrategia de evasión activa, la población cancerosa posee información clave -por ejemplo, el número de TAA que posee y el nivel al que las células inmunitarias atacan activamente a los TAA- y basa su estrategia en estos datos.
El equipo modeló y resolvió matemáticamente el comportamiento dinámico de ambas estrategias -las tácticas de evasión pasiva y activa- y las probó con diferentes entornos inmunitarios a lo largo del tiempo, desde un entorno inmunitario hostil con un gran número de células inmunitarias que reconocen todos los TAA hasta un entorno menos hostil con menos células que reconocen los TAA.
«Los cánceres que se adaptan activamente son, por diseño, más difíciles de tratar. Pero nuestro modelo predice que, en algunos casos, las poblaciones de cáncer pagan una penalización por sobrevivir hoy contra el reconocimiento inmunitario que podría ser objeto de tratamiento terapéutico mañana», afirma George. «Este trabajo inicial motiva una intrigante dirección de investigación para identificar estrategias terapéuticas óptimas contra enfermedades adaptativas o ‘inteligentes’ como el cáncer, y sin duda se beneficiarán de la modelización matemática».
El modelo proporciona información clave que, según los autores, será esencial para aprovechar el potencial de la inmunoterapia para mantener a raya los tumores de cada paciente durante muchos años.
«Derrotar a una población de cáncer altamente adaptable ha supuesto un reto persistente para investigadores y clínicos. El progreso será posible gracias a los descubrimientos fundamentales sobre el comportamiento del cáncer y a los conocimientos adicionales concomitantes sobre su evasión», afirma Herbert Levine, coautor del estudio y profesor adjunto de Bioingeniería en la Universidad Rice de Houston (EE.UU.) y catedrático distinguido de Física y Bioingeniería en la Universidad Northeastern de Boston (EE.UU.).
Abril 25/2023 (MedicalXpress) – Tomado de Oncology & Cancer Immunology Copyright Medical Xpress 2011 – 2023 powered by Science X Network
Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator
abr
25
Un proyecto de investigación internacional, en el que participa la Universidad de Oviedo, ha permitido identificar el papel concreto de los interferones como marcador clínico en el abordaje del lupus eritematoso sistémico (LES) para predecir la respuesta al tratamiento, así como otras posibles aplicaciones en diferentes enfermedades reumáticas y musculoesqueléticas.
Si bien existen numerosos trabajos que estudian desde hace décadas el papel de los interferones en diversas patologías de este tipo, como lupus eritematoso sistémico (LES), artritis reumatoide, esclerosis sistémica o síndrome de Sjögren, entre otras, su utilidad en la clínica ha quedado muy limitada por la falta de evidencia científica robusta en una dirección concreta, según Javier Rodríguez-Carrio, profesor del área de Inmunología de la Universidad de Oviedo y autor principal de este estudio, que acaba de ser publicado en Annals of the Rheumatic Diseases.
Para tratar de dar respuesta a este interrogante, un grupo internacional de investigadores desarrolló un proyecto al amparo de la Alianza Europea de Asociaciones de Reumatología (Eular), organismo de referencia en reumatología a nivel europeo, y que ha sido coordinado desde la Universidad de Leeds (Reino Unido), el centro médico Erasmus (Países Bajos) y con participación de la Universidad de Oviedo.
El proyecto se desarrolló en dos fases. Inicialmente se realizó una revisión sistemática de toda la literatura científica al respecto, con identificación de más de 10.000 trabajos científicos que abarcaban diferentes aplicaciones de los interferones en 11 enfermedades reumáticas y musculoesqueléticas, de los cuales 400 fueron los que cumplieron con los criterios de calidad necesarios para ser incluidos en esta revisión. En una segunda fase, el grupo de investigadores desarrolló un trabajo de consenso y elaboración de recomendaciones siguiendo una metodología definida basada en la evidencia.
¿Por qué tantos estudios sobre interferones?
«El primer resultado que nos sorprendió fue la enorme cantidad de ensayos propuestos para analizar los interferones», señala Javier Rodríguez-Carrio, quien explica que esto es debido en parte a que estos mediadores pueden no solo ser analizados por sus niveles, es decir, la cantidad de moléculas, sino también por sus efectos a nivel molecular y celular, o lo que es lo mismo por el tipo de respuesta que inducen sobre diversos biológicos.
Este hecho limita «enormemente la comparación entre diferentes tipos de ensayos y dificulta su estandarización» explica Javier Rodríguez-Carrio.
Esta fase sirvió además para señalar los posibles usos clínicos para los que existe un mayor respaldo científico, así como apuntar aquellas aplicaciones para las que se requiere más investigación.
«Uno de los objetivos de este trabajo era señalar específicamente qué huecos encontrábamos en la literatura científica y qué necesidades clínicas no cubiertas requerían más investigación y para qué patologías en concreto», señala el investigador. En esta fase, los investigadores concluyeron que los ensayos para medir interferones pueden tener un uso válido, sobre todo, en pacientes de lupus eritematoso sistémico (LES) para ciertas decisiones clínicas, así como en pacientes con miositis para algunos usos más concretos. La evidencia en otras patologías, como la artritis reumatoide, era menor pero enormemente prometedora».
En la segunda fase, el grupo de trabajo elaboró una lista de recomendaciones que permiten guiar desde el uso y elección racional de estos ensayos, hasta la publicación y análisis de los resultados, pasando por la recomendación de qué aplicaciones pueden ser aconsejables y cuáles no están avaladas por la literatura científica
Abril 25/2023 (Diario Médico) – Tomado de Inmunología – Estudio español en ‘Annals of the Rheumatic Disease Copyright Junio 2018 Unidad Editorial Revistas, S.L.U.
abr
22
Los resultados del ensayo de fase III KEYNOTE-966 indican que la adición de pembrolizumab a la quimioterapia con gemcitabina y cisplatino ofrece mayor beneficio que la quimioterapia sola en pacientes con cáncer de los conductos biliares. El estudio ha incluido pacientes procedentes de 175 centros en todo el mundo, con enfermedad localmente avanzada o metastásica y tumores irresecables, que no habían recibido ninguna terapia previa. El tratamiento intravenoso con pembrolizumab cada 3 semanas durante un máximo de 35 ciclos resultó en una mediana de supervivencia global (SG) de 12.7 meses, frente a 10.9 meses en el grupo de quimioterapia. Tanto los efectos adversos de grados 3 o 4 globales como los relacionados con el tratamiento exhibieron una frecuencia similar en ambos grupos.
Robin Kate Kelley, científica del Helen Diller Family Comprehensive Cancer Center de San Francisco y primera autora del estudio, afirma que los resultados son consistentes con los de un ensayo de fase III previo en pacientes de características similares, en los que la adición de durvalumab al mismo régimen quimioterapéutico prolongó significativamente la SG. A diferencia de ese ensayo, el actual no sólo ha incluido un número mucho mayor de pacientes, sino que también ha considerado variables clínicas, tales como la presencia y evolución de la infección por los virus de la hepatitis B o C, asegura la investigadora. Los hallazgos abren una potencial nueva vía de tratamiento, ya que en los pacientes cuya enfermedad progresa con gemcitabina y cisplatino la alternativa actualmente recomendada es una combinación con fluorouracilo, la cual muestra sólo una modesta eficacia.
Abril 21/2023 (IMmédico) – Tomado de Oncología https://www.immedicohospitalario.es/noticia/38652/pembrolizumab-avanza-en-el-cancer-de-los-conductos-biliares.html Copyright 2023: Publimas Digital.