feb
23
 Una donación múltiple de órganos realizada en un hospital español posibilitó seis trasplantes, un récord para un solo donante, informaron este jueves las autoridades sanitarias.
Una donación múltiple de órganos realizada en un hospital español posibilitó seis trasplantes, un récord para un solo donante, informaron este jueves las autoridades sanitarias.
La operación fue dirigida por el hospital universitario Torrecárdenas de Almería (sureste), en coordinación con otros centros sanitarios de España, país líder mundial de donación y trasplante de órganos. El coordinador de trasplantes de Torrecárdenas, Francisco Guerrero, subrayó que, gracias a la generosidad de una familia, fue posible esta donación múltiple, que supone un récord de trasplantes realizados de un solo donante.
En los trasplantes de corneas y múltiples trasplantes de tejido isteotendinosos colaboraron equipos llegados de varias regiones españolas al hospital almeriense.
La gerencia del hospital agradeció la solidaridad de la familia que, pasando por un duro trance, facilitó la donación.
Los profesionales de varias especialidades tanto del hospital de Almería como de otros lugares estuvieron más de veinticuatro horas efectuando todos los procedimientos.
España efectuó de media 16 trasplantes diarios en 2023, hasta alcanzar los 5.861, un 9 por ciento más que el año anterior, una cantidad que rebasa el máximo histórico que alcanzó antes de la pandemia y que la mantiene como referente mundial en esta actividad desde hace 32 años consecutivos.
Del mismo modo, 2.346 personas dieron uno de sus órganos tras fallecer (un 7 % más), a las que se sumaron las 435 personas que donaron en vida (433 un riñón y 2 parte de su hígado), lo que arroja una tasa de 48,9 donantes por millón de población (p.m.p), según datos de la Organización Nacional de Trasplantes.
Guerrero explicó que se asiste ‘cada vez con más frecuencia’ a familias que ofrecen espontáneamente la donación de órganos y tejidos cuando son informados del diagnóstico de enfermedades críticas de pronóstico infausto.
Este compromiso creciente de la sociedad nos posibilita tratar a esos pacientes en lista de espera, que necesitan estos trasplantes de órganos y tejidos, para solucionar problemas de salud que no disponen de otras alternativas de tratamiento’, explicó el coordinador de trasplantes del centro almeriense.
22 febrero 2024 | Fuente: EFE | Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A
ene
9
 Roy Calne, un pionero en los trasplantes de órganos que dirigió la primera operación de trasplante de hígado en Europa en 1968, murió a la edad de 93 años. La familia de Calne señaló que murió la tarde del sábado en Cambridge, Inglaterra, donde fue profesor emérito de cirugía en la Universidad Cambridge.
Roy Calne, un pionero en los trasplantes de órganos que dirigió la primera operación de trasplante de hígado en Europa en 1968, murió a la edad de 93 años. La familia de Calne señaló que murió la tarde del sábado en Cambridge, Inglaterra, donde fue profesor emérito de cirugía en la Universidad Cambridge.
Nacido en 1930, Calne fue capacitado como médico en el Hospital de Londres de Guy y desarrolló un interés en el trasplante de órganos en la década de 1950, en parte inspirado, según dijo después, por el trabajo de su padre como mecánico de autos. En aquella época le dijeron que el procedimiento sería imposible.
Es considerado uno de los padres de los trasplantes de órganos, junto con el científico estadounidense, doctor Thomas Starzl. Su trabajo en el procedimiento quirúrgico y tratamiento para prevenir el rechazo de órganos inicialmente se realizó en perros.
En 1960, los experimentos en perro de Calne demostraron por primera vez que un medicamento podría evitar el rechazo de órganos. Starzl intentó el primer trasplante de hígado humano en 1963. El paciente murió durante el procedimiento.
Los siguientes pacientes también murieron semanas después de sus trasplantes, pero las cirugías demostraron que los hígados trasplantados podían funcionar. ‘Al principio fue terrible. Tuvimos muchas complicaciones espantosas’, dijo Calne en 1999.
En mayo de 1968, Calne dirigió una operación de trasplante en una mujer de 46 años con cáncer de hígado en el Hospital de Addenbrooke en Cambridge. La paciente murió dos meses después de una infección debido a los medicamentos inmunosupresores que recibió para evitar el rechazo.
Calne se enfocó en encontrar mejores formas para evitar que los cuerpos de los pacientes rechazaran los órganos donados. Ayudó a desarrollar la innovadora medicina ciclosporina, que evita el rechazo, y fue el primer médico en administrarla a sus pacientes de trasplantes. Los medicamentos antirechazo cambiaron las posibilidades de sobrevivir de los pacientes, y los trasplantes de hígado han salvado miles de vidas desde que fueron aceptados ampliamente en la década de 1980.
Enero 9 2024 /Fuente: AP./ Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
oct
24
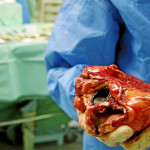 Lawrence Faucette se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo y, un mes después, no muestra señales de que su cuerpo rechace el órgano.
Lawrence Faucette se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo y, un mes después, no muestra señales de que su cuerpo rechace el órgano.
Ha pasado un mes desde que un hombre de Maryland se convirtió en la segunda persona en recibir un corazón trasplantado de un cerdo, y un video del hospital difundido el viernes lo muestra trabajando duro para reponerse.
Lawrence Faucette estaba a punto de morir por insuficiencia cardiaca y no era elegible para un trasplante de corazón tradicional debido a otras complicaciones de salud cuando los médicos de la Facultad de Medicina de la Universidad de Maryland le ofrecieron esa cirugía altamente experimental.
En las primeras imágenes de Faucette desde el trasplante del 20 de septiembre, un video del hospital muestra al fisioterapeuta Chris Wells instándole a sonreír mientras pedalea para recuperar fuerzas.
“Va a estar difícil, pero triunfaré», contesta Faucette, de 58 años, resoplando pero esbozando una sonrisa.
El equipo de Maryland realizó el año pasado el primer trasplante mundial de un corazón de un cerdo genéticamente modificado a otro hombre moribundo.
David Bennett sobrevivió solamente dos meses antes de que ese corazón dejara de funcionar por razones que no están completamente claras, aunque más tarde se encontraron evidencias de un virus porcino en el interior del órgano.
Lo aprendido en aquel primer experimento produjo varios cambios antes de este segundo intento, entre ellos la mejora de las pruebas de detección de virus.
Los intentos de trasplante de órganos de animales a humanos —los llamados xenotrasplantes— han fracasado durante décadas, ya que el sistema inmunitario de las personas destruía de inmediato el tejido extraño. Ahora los científicos vuelven a intentarlo con cerdos modificados genéticamente para que sus órganos sean más parecidos a los humanos.
En el video del hospital difundido el viernes, los médicos de Faucette dijeron que el corazón de cerdo no ha presentado síntomas de rechazo.
“Su corazón está haciendo todo autónomamente”, dijo el doctor Muhammad Mohiuddin, jefe de xenotrasplantes cardiacos del equipo de Maryland.
Una vocera del hospital dijo que Faucette, de Frederick, Maryland, ha podido levantarse y que los fisioterapeutas lo están ayudando a ganar las fuerzas necesarias para intentar caminar.
Muchos científicos esperan que algún día los xenotrasplantes puedan compensar la enorme carencia de donaciones de órganos humanos. Más de 100 mil personas están en la lista de trasplantes de Estados Unidos, la mayoría a la espera de un trasplante de riñón, y miles morirán esperando.
Un puñado de equipos científicos han probado riñones y corazones de cerdos en monos y en cuerpos humanos donados, esperando aprender lo suficiente para que la Administración de Alimentos y Medicamentos de Estados Unidos les permita realizar estudios formales de xenotrasplantes.
24 octubre 2023| Fuente: Proceso| Tomado de Noticias Medicina | Ciencia -Tecnología
oct
13
 Los investigadores realizaron 69 modificaciones genéticas para lograr evitar el rechazo hiperagudo, la reacción habitual ante un trasplante entre especies diferentes.
Los investigadores realizaron 69 modificaciones genéticas para lograr evitar el rechazo hiperagudo, la reacción habitual ante un trasplante entre especies diferentes.
Obtener órganos de ‘repuesto’, desarrollados en animales y disponibles para el trasplante en humanos, es un objetivo que persiguen diferentes grupos de investigación en todo el mundo.
Aunque en 2022 se llevaron a cabo varios xenotrasplantes experimentales, como la implantación de un corazón de cerdo modificado genéticamente a un paciente de Baltimore que sufría una grave enfermedad cardiaca; este tipo de abordaje todavía está lejos de llegar a la clínica. Antes, se deben solventar desafíos biotecnológicos importantes que plantea el ‘salto’ entre especies, como el rechazo hiperagudo tras el injerto o el riesgo de zoonosis.
Una investigación liderada por científicos de la Universidad de Harvard y la compañía eGenesis allana ese camino al haber conseguido implantar riñones de cerdo editados genéticamente en macacos y lograr unas cifras de supervivencia reseñables. Uno de los ejemplares trasplantados vivió más de dos años con el injerto de riñón. Los detalles de la investigación se publican en la revista Nature.
Para minimizar el riesgo de rechazo y la posibilidad de transmisión de virus porcinos con el trasplante, los investigadores realizaron 69 modificaciones genéticas en el animal donante, un cerdo de Yucatán.
Estas modificaciones pueden agruparse en tres bloques: en primer lugar, eliminaron tres antígenos glicanos, ‘marcadores’ presentes en la superficie de las células que inducen un rechazo inmediato. Además, introdujeron cambios para que las células animales expresaran siete genes humanos con el objetivo de mejorar la tolerancia y neutralizar otros fenómenos asociados al rechazo hiperagudo. Y, por último, inactivaron todas las copias de la genética relacionada con retrovirus porcinos.
En combinación con medicación inmunosupresora, este cóctel de ingeniería genética proporcionó una supervivencia de hasta 758 días a uno de los macacos trasplantados.
CLAVES DEL XENOTRASPLANTE
Una de las principales claves para conseguir esa prolongada supervivencia fue la manipulación para añadir los genes humanizados, implicados en varias vías relacionadas con el rechazo, como la inflamación, la inmunidad innata o la coagulación, tal y como explicaron los investigadores en una rueda de prensa.
Los estudios in vitro, señalan los científicos, mostraron que las células endoteliales renales de los animales con estas ediciones genéticas eran capaces de modular la inflamación de una forma «indistinguible» de las células endoteliales humanas. «Nuestros resultados nos colocan un paso adelante para alcanzar la compatibilidad humana», subrayó Michael Curtis, responsable de eGenesis en el encuentro con la prensa.
Este diseño y desarrollo se trata de una «prueba de concepto» que «apoya el avance hacia el desarrollo clínico» del principal candidato que la compañía eGenesis está diseñando para el trasplante de riñón, denominado EGEN-2784, ha señalado la compañía en un comunicado.
Para Beatriz Domínguez-Gil, directora de la Organización Nacional de Trasplantes (ONT), este diseño «se trata de un modelo que proporciona resultados muy prometedores».
Domínguez-Gil destaca el diseño de modificaciones genéticas que ha permitido alcanzar «una supervivencia prolongada en primates no humanos».
Pero, además, hace hincapié en el hecho de que el desarrollo proporciona «un modelo experimental que nos va a permitir avanzar en el ámbito del xenotrasplante de una forma mucho más segura».
Este diseño permite dar un paso importante «a la hora de demostrar que un abordaje es seguro y eficaz antes de dar el salto a la realización de ensayos clínicos».
Desde esas dos perspectivas, «es un estudio muy novedoso y de mucha relevancia», subraya Domínguez-Gil, que también apunta que la utilización de este tipo de primates no humanos como receptores en los experimentos puede facilitar la traslación posterior de los resultados a la clínica. «Es un modelo probablemente más trasladable a la realidad del humano que los que se han utilizado previamente», destaca.
UN LARGO CAMINO POR RECORRER
De cualquier manera, la directora de la ONT recuerda que «todavía quedan muchísimos pasos en este en ese camino de llevar el xenotrasplante a la clínica».
Queda mucho trabajo por realizar en el ámbito preclínico, subraya Domínguez-Gil. En este sentido, los propios investigadores reconocen en la revista científica que las modificaciones genéticas planteadas deben afinarse para conseguir resultados clínicos.
Pero, además, también hay que abordar las cuestiones éticas que plantea este tipo de procedimientos. «Entre otras cosas, se tiene que decidir cuál es el paciente al que se le va a ofrecer esta opción frente a la alternativa; es decir, qué criterios tiene que cumplir un paciente para entrar en un ensayo clínico de estas características cuando tenemos ya un tipo de trasplante entre humanos muy consolidado, que es una realidad clínica ya habitual y que ofrece extraordinarios resultados», señala.
También hay que abordar cuestiones relacionadas con la protección de los animales, así como la planificación de cómo se va a lograr que estos tratamientos «extraordinariamente costosos» puedan llegar a los pacientes de una forma equitativa, plantea la directora de la ONT.
«Hay muchas cuestiones que avanzar y que tener en cuenta, pero yo creo que en los próximos 10 años sí vamos a ver un salto importante a la clínica de esta opción terapéutica», concluye Domínguez-Gil.
Referencia
Anand RP, Layer JV, Heja D, Hirose T, Lassiter G, Firl D, et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature[Internet]. 2023[citado 12 oct 2023]; 622, 393–401. https://doi.org/10.1038/s41586-023-06594-4
13 octubre 2023│Fuente: El Mundo│ Tomado de Salud
sep
22
 Los dispositivos de implante cerebral podrían tener un impacto transformador en la salud humana. Ahora la empresa de Elon Musk, Neuralink, puede probar sus implantes en un ensayo con humanos.
Los dispositivos de implante cerebral podrían tener un impacto transformador en la salud humana. Ahora la empresa de Elon Musk, Neuralink, puede probar sus implantes en un ensayo con humanos.
«El futuro va a ser un lugar extraño», dijo Elon Musk en 2020, al explicar los posibles usos de los implantes cerebrales desarrollados por su empresa de neurotecnología Neuralink.
Durante los últimos siete años, la empresa ha estado desarrollando un chip informático diseñado para ser implantado en el cerebro, donde monitoriza la actividad de miles de neuronas.
El chip, oficialmente considerado una «interfaz cerebro-ordenador» (BCI), consiste en una minúscula sonda que contiene más de 3.000 electrodos unidos a hilos flexibles más finos que un cabello humano.
Musk quiere vincular el cerebro con los ordenadores para poder descargar información y recuerdos del interior de la mente, como en la película de ciencia ficción «Matrix», de 1999.
Además de utilizar la tecnología para tratar enfermedades como la ceguera y la parálisis, Musk ha expresado su ambición de utilizar Neuralink para lograr la telepatía humana, que, según él, ayudaría a la humanidad a prevalecer en una guerra contra la inteligencia artificial. También ha dicho que quiere que la tecnología proporcione a la gente «supervisión».
Neuralink reveló el martes (19.09.2023) que ha recibido la aprobación de la Administración de Alimentos y Medicamentos de EE.UU. (FDA) para poner en marcha su primer estudio clínico en humanos.
¿Ciencia ficción o realidad
¿Son factibles algunas de las ideas de ciencia ficción de Musk? La respuesta es: no.
«No podemos leer la mente de las personas. La cantidad de información que podemos descodificar del cerebro es muy limitada», afirma Giacomo Valle, ingeniero neuronal de la Universidad de Chicago (Estados Unidos).
Juan Álvaro Gallego, investigador en BCI del Imperial College de Londres (Reino Unido), se muestra de acuerdo, y afirma que es difícil imaginar que las BCI nos lean la mente en esta vida.
Un mono implantado con Neuralink juega a Pong con su mente.Imagen: Youtube.com/Neuralink
ʺEl problema fundamental es que no sabemos realmente dónde o cómo se almacenan los pensamientos en el cerebro. No podemos leer los pensamientos si no entendemos la neurociencia que hay detrás de ellos», declaró Gallego a DW.
Usos clínicos de las BCI basados en la realidad
Musk mostró por primera vez la tecnología Neuralink en 2019, presentando un cerdo con un chip Neuralink implantado en el cerebro y un video de un mono controlando una paleta del videojuego Pong con la mente.
Pero el potencial de las BCI va mucho más allá de unos animales que juegan.
Según Gallego, esta tecnología se desarrolló en un principio para ayudar a comunicarse a personas paralizadas por lesiones medulares o afecciones como el síndrome de enclaustramiento, en el que el paciente está plenamente consciente pero no puede mover ninguna parte del cuerpo excepto los ojos.
ʺSi pudiéramos traducir su comunicación interna a palabras en un ordenador, cambiaría su vidaʺ, afirma Gallego.
El nacimiento de la neuroética
A largo plazo, según Valle, las BCI plantean «una serie de problemas éticos» que deberán ser estudiados detenidamente por investigadores, empresas, organismos de financiación, reguladores y los propios usuarios.
La tecnología está dando lugar a un nuevo campo de investigación moral: la neuroética. Es aquí donde los debates se vuelven más de ciencia ficción.
ʺPor ejemplo, ¿cuáles son las consecuencias de las violaciones de la privacidad cuando los datos en cuestión se refieren a los pensamientos de las personas? ¿Cómo garantizar que la falta de acceso no agrave la desigualdad social? ¿Qué ocurre cuando esta información puede introducirse directamente en el cerebro? ʺ, plantea Valle.
Al fin y al cabo, el papel de la ciencia ficción es prepararnos para lo que pueda depararnos el futuro.
Las advertencias sobre la vigilancia y el control tecnológico ya estaban presentes en novelas de principios del siglo XX, como «Un mundo feliz», de Aldous Huxley, y «1984», de George Orwell. ¿Las hemos escuchado?
Referencia
Neuralink Clinical Trial. Neuralink’s First-in-Human Clinical Trial is Open for Recruitment.
20/09/2023
Fuente: (DW.com) Tomado Ciencia- Global
© Neuralink 2023
sep
16
 Una nueva investigación en monos sugiere que AT-1501 podría reducir o incluso eliminar la necesidad de medicamentos contra el rechazo de por vida. Ahora se está probando en ensayos en humanos.
Una nueva investigación en monos sugiere que AT-1501 podría reducir o incluso eliminar la necesidad de medicamentos contra el rechazo de por vida. Ahora se está probando en ensayos en humanos.
Un anticuerpo fabricado en laboratorio podría algún día hacer que los trasplantes de órganos sean menos difíciles, sugiere una investigación reciente. En experimentos con primates no humanos, el anticuerpo parecía ser seguro y eficaz para prevenir el rechazo de riñones y células pancreáticas trasplantadas. Los científicos esperan que este tratamiento pueda reducir o incluso eliminar la necesidad de medicamentos contra el rechazo de por vida con ciertos tipos de trasplantes.
El anticuerpo se nombra tegoprubart, también anteriormente conocido como AT-1501. Es un fármaco experimental que fue desarrollado inicialmente como un tratamiento potencial para la esclerosis lateral amiotrófica, o ALS. Fue creada por investigadores del ALS Therapy Development Institute (ALS TDI), una biotecnología sin fines de lucro, y ahora se está desarrollando a través de una asociación con la empresa Eledon Pharmaceuticals, Inc.
Si bien el tegoprubart todavía se está probando en ensayos en humanos en etapa avanzada para la ELA (con resultados prometedores Hasta ahora), los científicos también han comenzado a explorar si puede ayudar también a los pacientes trasplantados. El fármaco se dirige a una molécula producida por algunas células T, suprimiendo efectivamente un tipo específico de respuesta inmune que se observa comúnmente en la ELA. Esta misma respuesta inmune también parece desempeñar un papel papel en cómo el cuerpo rechaza los órganos donados.
Esta nueva investigación fue publicado A finales del mes pasado en la revista Science Translational Medicine. Científicos de la Universidad de Miami y la Universidad de Duke probaron AT-1501 en monos que recibieron dos tipos diferentes de trasplantes: trasplantes de riñón y trasplantes de células de los islotes. Las células de los islotes provienen del páncreas y producen insulina. Los trasplantes son un procedimiento experimental que se está desarrollando como tratamiento para la diabetes tipo 1 (las personas con esta afección no pueden crear su propia insulina debido a la destrucción de sus células de los islotes).
En ambos escenarios, descubrieron los investigadores, AT-1501 pareció mejorar la seguridad y eficacia de estos trasplantes. El medicamento pudo prevenir el rechazo agudo de riñones trasplantados por sólo, sin la necesidad de más medicamentos inmunosupresores. No sucedió lo mismo para los islotes Trasplantes de células, pero el fármaco pareció mejorar la supervivencia de estas células cuando se toma en combinación con la terapia antirrechazo estándar, y con menos efectos secundarios de lo habitual, como infecciones.
Otro hallazgo clave fue la falta de problemas de coagulación observados después del tratamiento. Ese es un efecto secundario que se observó con un anticuerpo experimental más antiguo: uno eso condujo a problemas de seguridad inesperados y posiblemente incluso a algunas muertes en los primeros ensayos en humanos. Las consecuencias posteriores han retrasado el desarrollo clínico de estos anticuerpos como tratamiento para trasplantes durante décadas, pero parece que los científicos finalmente podrían haber encontrado una versión verdaderamente segura de esta clase de drogas.
“Estos datos respaldan al AT-1501 como un agente seguro y eficaz para promover la supervivencia y el funcionamiento de los trasplantes de islotes y de riñón y nos permiten avanzar hacia los ensayos clínicos de inmediato”, afirmó el autor del estudio, Allan Kirk, presidente del Departamento de Cirugía de Duke, en un declaración de la universidad. “Este enfoque menos tóxico se ha seguido durante más de 20 años, y creo que finalmente estamos en un cambio punto. Esto podría ser un gran avance para las personas que necesitan trasplantes de órganos”.
Eledon Pharmaceuticals ya ha comenzado a realizar pequeños ensayos en humanos de tegoprubart para pacientes trasplantados. A principios de abril, reportado los resultados iniciales de su estudio de Fase Ib, que no encontró rechazo agudo ni problemas de seguridad relacionados en un grupo de 12 pacientes tratados trasplantes de riñón. Además de la ELA y el trasplante de órganos, el medicamento también se está estudiando como tratamiento para enfermedad de berger, una condición autoinmune que daña los riñones.
Referencia
Anwar IJ, Berman DM, DeLaura I, Gao Q, Willman MA, Miller A, et al. The anti-CD40L monoclonal antibody AT-1501 promotes islet and kidney allograft survival and function in nonhuman primates. Sci Transl Med. 2023;15(11): eadf6376. doi: 10.1126/scitranslmed.adf6376. https://pubmed.ncbi.nlm.nih.gov/37647390/
Fuente:( GIZMODO) Tomado- Ciencia © 2023 G/O Media

