mar
22
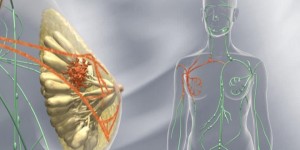
 El Hospital de Sant Pau de Barcelona ha logrado demostrar, en una muestra de 50 pacientes operadas de cáncer de pecho seguidas durante tres años, que es posible reducir el riesgo de linfedema a solo el 3% reconstruyendo la mama y el sistema linfático en la misma intervención en la que (como paso inicial) se realiza la cirugía oncológica.
El Hospital de Sant Pau de Barcelona ha logrado demostrar, en una muestra de 50 pacientes operadas de cáncer de pecho seguidas durante tres años, que es posible reducir el riesgo de linfedema a solo el 3% reconstruyendo la mama y el sistema linfático en la misma intervención en la que (como paso inicial) se realiza la cirugía oncológica.
El resultado de ese abordaje preventivo es relevante, si se tiene en cuenta que el linfedema, una enfermedad causada por la acumulación anormal de líquido en los tejidos blandos por una interrupción o alteración del sistema linfático tras el vaciado ganglionar, es la secuela más condicionante, invalidante y limitante tras la cirugía mamaria y de la radioterapia. También comporta un riesgo inmunológico importante, ya que puede causar linfangitis o infecciones del brazo que muchas veces requieren ingreso hospitalario y que incluso pueden acabar generando sepsis, con el riesgo vital que eso supone para la paciente.
Los resultados los ha presentado hoy en una rueda de prensa con motivo de la celebración en el mismo centro del Barcelona Breast Meeting, el congreso europeo que reúne a los referentes mundiales en cirugía mamaria oncológica, reconstructiva y estética. Según ha explicado Jaume Masià, director del Servicio Mancomunado de Cirugía Plástica del Hospital de Sant Pau – Hospital del Mar, son, por ahora, los únicos en Europa en aplicar esa técnica, en la que empezaron a trabajar en 2012 – “al principio era frustrante y la sociedad juzga al que se sale la norma, pero el tiempo te muestra el camino”, ha manifestado el cirujano- y que ahora usan de manera sistemática (llevan en total 80 casos).
Aplicarla obliga, de entrada, a planificar muy bien la extirpación completa del tumor y la reconstrucción inmediata de la mama y del sistema linfático, para minimizar al máximo posible las secuelas. Luego se realiza todo lo proyectado, que requiere microcirugía de precisión, con ayuda de un robot quirúrgico. Se da la circunstancia de que el Sant Pau es también el primer centro del sur de Europa -y cuarto del mundo- que cuenta con el primer robot de supermicrocirugía en linfedema (llamado Symani).
Ha precisado Masià que estudiando bien la axila y el brazo para reconstruir en la misma operación también el sistema linfático es posible evitar el linfedema a 97 de cada 100 pacientes, porque se reduce el riesgo del 32% -que es el porcentaje con el abordaje convencional- a solo un 3%. Y ha recordado que la cirugía del linfedema ha mejorado pero no “al 100%, por eso hay que prevenir”.
Aprendizaje largo y tecnología avanzada
Para generalizar esta técnica se requiere “un aprendizaje largo y tecnología robótica avanzada”, ha dicho el cirujano, que cree que su uso tardará en estar extendido al menos unos 5-10 años.
Masià, que ha destacado asimismo que “Sant Pau es una escuela (es la sede de la European School of Reconstructive Microsurgery) reconocida en toda Europa y en el mundo en este ámbito y hemos creado un polo de excelencia y de docencia que es un referente indiscutible”, ha contado con el testimonio positivo de dos pacientes, Eva y Marta, sometidas a la nueva técnica, una de ellas con reconstrucción posterior (segunda intervención) tras la cirugía oncológica.
En el Sant Pau hasta el 80% de las reconstrucciones mamarias son inmediatas (misma intervención); “hoy no hay nada que justifique no hacer la reconstrucción mamaria en la misma intervención donde operamos el tumor. Son contados los casos donde está justificado dejarlo para más adelante”, en opinión de Masià.
En el congreso se está abordando cómo, con la reconstrucción de la mama, mejorar las técnicas de reinervación del pezón, para conservar la sensibilidad erógena. Para tratar de lograrlo hay que buscar, en el momento de la mastectomía, los nervios que dan inervación a la mama y conectarlos a la estructura de reconstrucción, que suele ser tejido autólogo (por ejemplo, del glúteo de la propia paciente), con capacidad de ser reinervado.
Seguimiento de las pacientes con implantes mamarios
También se está tratando un problema relacionado con los implantes mamarios: hay que hacer seguimiento de las mujeres que los llevan porque pueden desarrollar linfoma anaplásico de células grandes, que se observa sobre todo en implantes texturados, ha indicado Masià.
“Después de 60 años de uso creciente de los implantes mamarios, aparece el carcinoma epidermoide y nuevas enfermedades que antes pasaban desapercibidas pero que ahora ya no, debido a la mayor esperanza de vida y, por tanto, al mayor envejecimiento de los implantes y a los cambios histológicos que causan en el cuerpo de la mujer”, ha añadido.
Y ha defendido que no hay que alarmar –“los implantes son seguros (…), no hay que tener miedo” – pero sí concienciar a las mujeres y a los profesionales que las atienden de que hay que hacer un seguimiento constante para detectar, y tratar a tiempo, posibles problemas. Actualmente los casos de complicaciones en mujeres con implantes se registran en algunos países y en otros no; en este caso la causa suele ser que no se hace seguimiento a las mujeres que los llevan.
21 marzo 2024| Fuente: Diario Médico| Tomado de | Medicina| Cirugía Plástica Estética y Reparadora
nov
4
 El cáncer de mama diagnosticado en el embarazo o el posparto tiene peor pronóstico, de ahí la necesidad de métodos eficaces de detección precoz, una evidencia que se constata a diario en la unidad multidisciplinaria específica para tratar estos casos dentro de la Unidad de Mama del Hospital Universitario Vall d’Hebron en Barcelona, España.
El cáncer de mama diagnosticado en el embarazo o el posparto tiene peor pronóstico, de ahí la necesidad de métodos eficaces de detección precoz, una evidencia que se constata a diario en la unidad multidisciplinaria específica para tratar estos casos dentro de la Unidad de Mama del Hospital Universitario Vall d’Hebron en Barcelona, España.
En esta línea, en la que trabaja el equipo liderado por la Dra. Cristina Saura, Ph. D., jefa de la unidad y también del Grupo de Cáncer de Mama del Vall d’Hebron Instituto de Oncología (VHIO), se sitúan los resultados de un estudio recientemente publicado en Cancer Discovery, y en el que por primera vez se ha demostrado que la leche materna de las pacientes con cáncer de mama contiene ADN tumoral circulante (ADNct), susceptible de ser detectado mediante una biopsia líquida de esa leche.
La Dra. Saura explicó a Medscape en español cuál fue el motivo —en cierta medida, «sobrevenido»— de poner en marcha esta investigación: «En este caso fue la inquietud de una paciente con cáncer de mama diagnosticada durante el embarazo de su tercera hija; fue de ella en realidad de quien surgió la idea del proyecto. Le preocupaba haber transmitido el tumor a través de la leche materna a su segunda hija durante el periodo de lactancia, que había sido largo y se había prolongado hasta poco tiempo antes del diagnóstico de su cáncer de mama, así que nos trajo una muestra de leche materna que tenía guardada en su congelador».
«Y es ahí, gracias a ella, donde empezó nuestro proyecto ya que, aunque sabemos que el cáncer de mama no se transmite a través de la leche materna, decidimos analizar la muestra a la búsqueda de marcadores que pudieran ayudarnos en la investigación. Y, efectivamente, al analizar la leche materna de la paciente, encontramos ADN con la misma mutación que estaba presente en su tumor», añadió la Dra. Saura, quien apuntó que la leche materna analizada se había congelado más de un año antes del diagnóstico de cáncer de la paciente.
En cuanto a la metodología, Ana Vivancos, Ph. D., jefa del Grupo de Genómica del Cáncer del VHIO y otra de las autoras del estudio, comentó que se emplearon dos técnicas, secuenciación de nueva generación (NGS) y reacción en cadena polimerasa digital de sola gota (ddPCR) para analizar las muestras de leche materna y de sangre, comprobando así la existencia de ADNct en la leche materna.
«Fuimos capaces de detectar mutaciones presentes en el tumor de pacientes con cáncer de mama en su muestra de leche en 13 de las 15 pacientes analizadas, mientras que en las muestras de sangre recogidas en el mismo momento solo se detectó ADN tumoral circulante en una de ellas», afirmó Vivancos. «En cuanto a las muestras de las dos pacientes en las que no se detectó mutación, se comprobó que eran de calostro recogido en las primeras horas de la lactancia».
Asimismo, para dar utilidad práctica a este hallazgo, el equipo investigador diseñó un papel genómico basado en secuenciación de nueva generación como posible método de detección precoz del cáncer de mama. «Hemos desarrollado un panel basado en química de captura híbrida y con identificadores moleculares únicos (UMIs) que aseguran una mejor sensibilidad en la secuenciación de nueva generación. El diseño del panel se ha ajustado, basándonos en la literatura existente, a los genes más frecuentemente mutados en el cáncer de mama en mujeres jóvenes, menores de 45 años».
Según Vivancos, este panel tiene una sensibilidad de más de 70%, lo que significa que de las muestras de las pacientes analizadas con este se hubieran detectado 7 de 10 casos con una especificidad de 100 %.
«En la práctica, el diseño del panel permitiría detectar alteraciones en más de 95 % de los casos de cáncer de mama en mujeres de edad inferior a 45 años. Por lo tanto, su uso en el escenario de detección precoz de este tumor durante la lactancia debería contribuir a resolver una necesidad médica no cubierta a día de hoy», señaló Vivancos.
En relación con esta necesidad no resuelta, la Dra. Saura incidió en que actualmente no se dispone de ningún sistema o herramienta que permita sospechar de forma precoz de un tumor de mama en embarazadas antes del diagnóstico, «y, precisamente, el objetivo de esta investigación, que ahora se tiene que validar con un grupo más grande de mujeres en un estudio clínico, sería implantar el cribado de cáncer de mama en mujeres que acaban de dar a luz».
Contacto más directo con las células tumorales
En opinión de la Dra. Saura, esto facilitaría que, al igual que en España se realiza la punción del talón con una pequeña muestra de sangre del recién nacido para descartar patologías metabólicas, se recogieran muestras de leche materna de todas las mujeres que den a luz, para descartar o diagnosticar el cáncer de mama.
En cuanto a las ventajas potenciales que tendría la biopsia líquida de leche materna frente a técnicas similares, como por ejemplo la biopsia líquida en sangre, Vivancos remitió a los resultados de su estudio: «Hemos visto que la biopsia líquida en leche materna era positiva para la presencia de ADN tumoral circulante en 87 % de los casos, mientras que la sangre solo mostró presencia de este marcador en 8%. Esta diferencia indica que la leche materna es un biofluido que está en contacto más directo con las células tumorales y que, por lo tanto, será más informativo en estadios más iniciales».
La Dra. Saura apuntó sobre estos tumores en embarazadas o en el posparto que los datos reafirman una realidad: «En general, suelen tener un peor pronóstico por ser, en una gran parte de los casos, un diagnóstico en estadios avanzados. Además, se suele asumir que hay alteraciones fisiológicas de la mama, consideradas normales durante la gestación y la lactancia, que pueden esconder un tumor en desarrollo. El hecho es que el cáncer de mama durante el posparto, entendiendo como posparto la definición actual que corresponde a los 10 años posteriores al parto, representa entre 40 % y 45 % de los casos de cáncer de mama diagnosticados antes de los 45 años».
Las investigadoras tienen previsto dar continuidad a este proyecto: «Nuestro siguiente paso para confirmar la utilidad de la leche materna como nueva herramienta de biopsia líquida para la detección precoz del cáncer de mama en el periodo posparto es realizar esta prueba no invasiva en miles de mujeres», informó la Dra. Saura.
Objetivo, «estandarizarla» como método de screening
«Basándonos en los resultados que hemos publicado, estamos iniciando un estudio dirigido a recoger muestras de leche materna de 5 000 mujeres sanas de todo el mundo que se hayan quedado embarazadas a partir de los 40 años o a cualquier edad que sean portadoras de mutaciones que aumentan su riesgo de padecer cáncer de mama», añadió la especialista.
Acerca de cuándo está previsto disponer de resultados preliminares de este nuevo estudio, la Dra. Saura afirmó que aún no es posible aventurarse a concretar este dato «ya que estamos pendientes de recibir financiación para avanzar en este trabajo, pero vamos analizando caso a caso y, por supuesto, si detectamos alguna anomalía en estas mujeres, seguiremos el protocolo establecido para confirmar el diagnóstico e iniciar un tratamiento si fuera preciso».
Sobre si es factible que la biopsia líquida de leche materna llegue a «normalizarse» como método de screening para las mujeres en edad reproductiva con antecedentes o factores de riesgo de desarrollar un cáncer de mama, Vivancos afirmó que «ese sería el escenario futuro que visualizamos y al que nos gustaría contribuir con evidencia científica para conseguir hacerlo realidad».
«Por el momento, nuestro objetivo es validar que el ADN tumoral circulante puede detectarse mediante biopsia líquida en la leche materna incluso antes de que el cáncer de mama pueda diagnosticarse mediante técnicas de imagen convencionales. Si validamos estos resultados preliminares podremos detectar precozmente el cáncer de mama con una prueba no invasiva como la biopsia líquida de la leche materna», señaló por su parte la Dra. Saura.
Finalmente, y en cuanto a las asignaturas pendientes que aún existen en la detección y el abordaje del cáncer de mama durante el embarazo, la especialista puso de relieve el impacto emocional que tiene para las mujeres y para su entorno el diagnóstico de un cáncer gestacional «pero lo primero que tienen que saber es que el diagnóstico no es necesariamente sinónimo de interrupción del embarazo, sino que este tumor se puede tratar durante la gestación ya que es posible hacer cirugía en cualquier momento y quimioterapia a partir del segundo trimestre. Prueba de ello son los 72 niños que han nacido en este contexto en los últimos 20 años en el Hospital Universitario Vall d’Hebrón, que es pionero en España gracias a un programa multidisciplinar para informar y hacer un seguimiento específico a las mujeres a las cuales se les diagnostica un tumor de mama durante el embarazo».
Referencia
Saura C, Ortiz C, Matito J, Arenas E, Suñol A, Martín A, et al. Early-Stage Breast Cancer Detection in Breast Milk. Cancer Discov[Internet].2023[citado 3 nov 2023];13(10):2180-2191. doi: 10.1158/2159-8290.CD-22-1340. PMID: 37704212. https://pubmed.ncbi.nlm.nih.gov/37704212/
4 noviembre 2023|Fuente: Medscape| Tomado de Noticias y Perspectivas
oct
23
 El despliegue de las tecnologías basadas en IA podría mejorar la detección precoz del cáncer y ayudar a compensar los retrasos diagnósticos en toda Europa.
El despliegue de las tecnologías basadas en IA podría mejorar la detección precoz del cáncer y ayudar a compensar los retrasos diagnósticos en toda Europa.
La inteligencia artificial (IA) ha entrado en el debate público por todo lo alto, pero los investigadores llevan tiempo estudiando su potencial para transformar la atención a las personas con cáncer y mejorar los resultados de los pacientes. En el Congreso ESMO 2023 en Madrid (España), del 20 al 24 de octubre habrá sesiones específicas centradas en la IA para dar a conocer los avances que se han hecho en términos de métodos de computación avanzados aplicados a la oncología.
La Ley de Amara dice que tendemos a sobreestimar el impacto inmediato de la tecnología y subestimar sus efectos a largo plazo. No obstante, como sucede con cualquier área de conocimiento relacionada con la salud humana, es necesario añadir cierta precaución al entusiasmo y, por lo tanto, nuevas tecnologías como la IA, el aprendizaje automático y el análisis de grandes cantidades de datos (`big data´) se están incorporando de manera más lenta y con más precauciones que en otros sectores. Los ejemplos de su aplicación en la práctica clínica hasta ahora se limitan a la clasificación (triaje) de imágenes de biopsias, mamografías y tomografías computarizadas (CT, por sus siglas en inglés) de pulmón usadas para realizar cribados de pacientes en función de la presencia de tumores, así como a algunas áreas de la investigación sobre el cáncer. No obstante, la implementación de estas tecnologías en la investigación oncológica y la práctica clínica más extendidas está lejos de ser homogénea, lo cual indica que existen barreras que pueden ralentizar su adopción y los beneficios que podrían aportar en los procesos de investigación y los cuidados del cáncer, incluyendo prevención, cribado y rutas de atención.
Aprovechar el potencial de la IA para mejorar la detección del cáncer
A partir de un estudio cualitativo presentado en el Congreso ESMO 2023, que explora el potencial de las tecnologías basadas en IA para mejorar la obtención de imágenes, el diagnóstico y los retrasos en el área de oncología en siete países europeos, la Dra. Raquel Pérez-López, radióloga del Instituto de Oncología Val d´Hebron de Barcelona, considera que las guías existentes sobre cribado y diagnóstico del cáncer, que están bien definidas, no se aplican de forma homogénea dentro de Europa, por razones que pueden incluir tanto aspectos económicos como culturales.
Pérez-López vio el potencial de las soluciones digitales emergentes para intervenir desde la base de la organización y anteponer el cribado de los pacientes a partir de sus historias clínicas. «Ya existen plataformas basadas en IA que permiten el análisis de datos recogidos de forma habitual en las historias clínicas electrónicas y en las unidades de imagen, y que podrían contribuir a los programas de prevención y cribado identificando a los individuos en riesgo de desarrollar la enfermedad, pero estos recursos están siendo infrautilizados», ha declarado Pérez-López, quien atribuye este fenómeno a la ausencia de un marco legal para que los datos de los pacientes sean utilizados en estos procesos.
Controlar la IA para potenciar la investigación en el mundo real
Aplicaciones menos tangibles, pero igualmente importantes de los métodos de computación avanzados están transformado algunas áreas de la investigación en oncología. En el campo de la genética del cáncer, por ejemplo, muchas de las mutaciones incluidas en los estudios genómicos modernos se emplean para identificar a los pacientes adecuados para recibir terapias dirigidas empleando herramientas de IA que comparan los perfiles genéticos de cientos de miles de personas y elaboran predicciones sobre la función de estas mutaciones en el riesgo de desarrollar cáncer. Estas tecnologías se han empezado a usar también recientemente de forma más extendida para analizar diversos tipos de datos incluidos en estudios de evidencia obtenida en el mundo real, que están ganando terreno como un medio de generar evidencia en campos como el de los cánceres raros, en los que no es posible realizar ensayos clínicos aleatorizados tradicionales, o para acercar los resultados de los ensayos clínicos y los resultados de los pacientes en la práctica clínica, entre los cuales se observan diferencias frecuentemente.
No es casual que la reciente publicación de la `ESMO Guidance for Reporting Oncology real-World evidence (GROW)´, desarrollada para orientar las publicaciones científicas en este campo, también aborden el asunto de las tecnologías basadas en IA. En particular, la guía ESMO-GROW tiene como objetivo armonizar las prácticas de la investigación oncológica proporcionando recomendaciones detalladas sobre las pruebas y pasos de validación necesarios para presentar datos obtenidos en el mundo real de forma precisa y transparente. Entre esas recomendaciones se incluyen consideraciones relacionadas con el empleo de algoritmos de IA para el análisis de datos en estudios sobre mundo real, una inclusión necesaria para plasmar todas las consideraciones relevantes y específicas al área de oncología y adelantarse a los avances que se presenten en el futuro.
«En el futuro próximo, podremos ver cómo las herramientas de IA transforman el procesamiento de datos dentro de los sistemas de información de los hospitales y de las historias clínicas haciendo posible que los médicos estructuren notas sin texto y obtengan resúmenes de grandes cantidades de información presionando un botón, lo cual facilitará en gran medida la obtención de datos del mundo real de las historias clínicas para generar nuevo conocimiento en la investigación», ha declarado el Dr. Rodrigo Dienstmann, redactor jefe de la revista ESMO Real World Data and Digital Oncology y Director de Oncoclínicas Precisión Medicine en Sao Paulo (Brasil), explicando además que el documento aborda este probable escenario en el cual los datos empleados para investigar ya no serán recogidos ni estructurados por expertos, sino procesados y resumidos por una máquina.
«Adoptar un método estándar para evaluar las tecnologías basadas en IA con el mismo grado de fiabilidad con el cual se evalúan los medicamentos en los ensayos clínicos será crucial para aprovechar al máximo sus beneficios, a la vez que se garantiza que su adopción no incrementa el riesgo de distorsiones que podría causar desigualdad en la atención a los pacientes», ha puntualizado Dienstmann.
Implementando la oncología digital en la práctica
La investigación en el mundo real impulsada por el análisis de datos avanzado está siendo cada vez más habitual en los ensayos clínicos, algo que también está empezando a extenderse entre las agencias reguladoras que lo emplean en los procesos de autorización de nuevos medicamentos. Por lo tanto, la capacidad de interpretar con precisión este tipo de evidencia será una habilidad esencial para todos los profesionales de la oncología en el futuro. La revista ESMO Real World Data and Digital Oncology es una nueva plataforma revisada por pares en abierto dedicada a la publicación de ciencia y formación de alta calidad sobre la transformación de la atención en cáncer con tecnologías digitales y del mundo real.
Según Dienstmann, los oncólogos -como grupo- no están preparados para esta evolución y tiene necesidades formativas que van a crecer en la misma medida en que lo haga la IA a los flujos de trabajo clínicos. «Hay mucha aprensión sobre el impacto que la IA tendrá en la profesión cuando las máquinas superen a los médicos en algunas de sus tareas tradicionales y repetitivas», cuenta. «Necesitamos formar a los médicos para que empleen estas herramientas con inteligencia y confianza a partir de una comprensión clara de sus valores y de sus limitaciones, para que las máquinas y las personas puedan conseguir, trabajando juntos, mejores resultados de los que obtendrían por separado. ESMO Real World Data and Digital Oncoogy va a ser una fuente para que los médicos se enfrenten a la incorporación de la oncología digital en su práctica habitual».
Referencia
Dienstmann R. ESMO Real-World Data and Digital Oncology: a journal to understand how health systems can help provide better cancer care[Internet]. ESMO Real-World Data and Digital Oncology [citado 21 oct 2023];2023. Disponible en: https://doi.org/10.1016/j.esmorw.2023.09.002
23 octubre 2023|Fuente: IMMÉDICO| Tomado de Oncología
oct
21
 Se describe el papel en la lactancia de una proteína que también es clave en el cáncer de mama.
Se describe el papel en la lactancia de una proteína que también es clave en el cáncer de mama.
La producción de leche en mamíferos es un proceso crucial para el organismo, perfeccionado a lo largo de la evolución. Los mecanismos moleculares que lo regulan son sofisticados, y se siguen investigando. Un nuevo estudio publicado en Nature Communications da un paso más para esclarecerlos, al profundizar en el papel de una proteína, RANK, que es esencial para el funcionamiento de las glándulas mamarias y también es clave en el cáncer de mama.
La producción de leche en mamíferos tiene lugar en el tejido epitelial mamario, formado por dos tipos principales de células: luminales y basales. Las luminales recubren la primera capa de los conductos mamarios y están implicadas en la generación en sí de la leche; las basales rodean a las luminales y originan la contracción que hace fluir la leche durante la lactancia.
Hay que tener en cuenta que los dos linajes de células, basales y luminales, proceden de las basales, que se diferencian en luminales en el embrión. Sin embargo, tras el nacimiento se especializan: las células basales solo generan basales y las luminales solo dan lugar a células luminales.
Una proteína implicada en el cáncer de mama
El nuevo estudio, dirigido por Eva González-Suárez, jefa del Grupo de Transformación y Metástasis del Centro Nacional de Investigaciones Oncológicas (CNIO), describe el comportamiento y la interacción de estos dos linajes celulares durante el embarazo y la lactancia y el papel de la proteína RANK.
Esta proteína centra el interés de González-Suárez desde que ella misma descubriera en 2010 que tiene un papel clave en el desarrollo del cáncer de mama. Actualmente el grupo cuenta con financiación del Consejo Europeo de Investigación (ERC) para desarrollar una nueva generación de fármacos contra el cáncer de mama dirigidos a bloquear la señalización a través de la proteína RANK.
La principal aportación del nuevo estudio ahora publicado, destaca González-Suárez, es «la creación de modelos animales con la proteína RANK eliminada solo en las células luminales o solo en las basales. Así se ha podido discriminar su función en cada tipo de células», algo que hasta ahora se desconocía.
El estudio muestra que las consecuencias de la eliminación de RANK sobre la funcionalidad de la glándula mamaria son distintas dependiendo de si las ratonas experimentan su primera gestación o la segunda, o si no han estado preñadas.
No hay leche en la primera gestación, pero sí en la segunda
Cuando se elimina RANK en las células luminales antes de que haya habido gestación, estas células empiezan a diferenciarse de forma aberrante en otras responsables de la fabricación de la leche en sí, llamadas alveolares. Pero la primera lactancia resulta fallida, porque estas células alveolares aberrantes no son capaces de producir leche.
En la segunda gestación las células luminales son aún más disfuncionales. Esto alerta a las células basales, que recuperan su capacidad de diferenciarse en células luminales alveolares, ahora sí competentes para producir leche. La lactancia, en esta segunda gestación, resulta por tanto exitosa. Es decir, gracias a esa «acción de rescate» de las células basales, que sí expresan RANK, tiene lugar una lactancia funcional. «Esa capacidad de bipotencia de las células basales es capaz de despertar en un contexto fisiológico, para restaurar un proceso tan importante como lactancia», explica González-Suárez.
Para la autora responsable del artículo «resulta muy interesante que, al no tener RANK, las células luminales se diferencien en alveolares de forma aberrante, incluso en ratones hembra que no han entrado aún en gestación. Y también es relevante esa diferencia entre lo que ocurre en la primera y la segunda gestación». En cuanto a la posibilidad de que estos procesos tengan un paralelismo en la lactancia humana, considera que «es probable, pero harían falta estudios para determinarlo».
Los coautores principales del artículo son la investigadora postdoctoral que co-lidera el estudio, Ana Sofía Rocha, del Instituto de Investigación Biomédica Bellvitge (IDIBELL), y Alejandro Collado-Solé, estudiante de doctorado en el Centro Nacional de Investigaciones Oncológicas (CNIO), ambos del grupo de Eva González-Suárez.
Referencia
Rocha AS, Collado-Sol, A, Graña-Castro O, Redondo Pedraza J, Soria Alcaide G, Cordero A, et al. Luminal Rank loss decreases cell fitness leading to basal cell bipotency in parous mammary glands. Nat Commun[Internet].2023[citado 20 oct 2023];14(1):6213. doi: 10.1038/s41467-023-41741-5.
21 octubre 2023 | Fuente: IMMedico| Tomado de Obstetricia y Ginecología
sep
15
 Un equipo de investigadoras del Vall d’Hebron Instituto de Oncología (VHIO) de Barcelona (España) ha comprobado que la leche materna contiene ADN de tumores de mama, lo que abre la puerta a que se pueda utilizar como una biopsia líquida para diagnosticar el cáncer en etapas tempranas.
Un equipo de investigadoras del Vall d’Hebron Instituto de Oncología (VHIO) de Barcelona (España) ha comprobado que la leche materna contiene ADN de tumores de mama, lo que abre la puerta a que se pueda utilizar como una biopsia líquida para diagnosticar el cáncer en etapas tempranas.
El estudio, publicado en la revista ‘Cancer Discovery’, parte de la preocupación de una paciente con cáncer de mama que temía haber transmitido la enfermedad a su bebé durante la lactancia, pues fue diagnosticada poco después de haber dejado de dar el pecho a su segunda hija y estando embarazada de su tercera. La jefa de la Unidad de Mama del Hospital Vall d’Hebron e investigadora del VHIO, Cristina Saura, ha explicado que esa paciente trajo una muestra de leche materna que tenía guardada en su congelador. ‘Si bien le dijimos que no había riesgo de transmitir el tumor, decidimos analizar la muestra a la búsqueda de marcadores que pudieran ayudarnos en la investigación’, ha relatado.
Las investigadoras observaron que, en esta bolsa, recogida unos 18 meses antes del diagnóstico, ya había ADN del tumor, conocido como ADN tumoral circulante (ADNct). Tirando del hilo, las investigadoras recogieron muestras de leche materna y sangre de más pacientes con cáncer de mama diagnosticadas durante el embarazo o el postparto, así como de mujeres sanas que estaban en curso de lactancia materna.
De 15 casos de mujeres con cáncer de mama ya diagnosticado durante el embarazo o en el postparto, en 13 de ellas se detectó en la leche la misma mutación que en el tumor que padecían; en cambio, en muestras de sangre solo una era positiva. ‘En tumores localizados, la liberación de ADN en la sangre es bajita y está muy diluido, pero en la lecha materna vemos que hay una cantidad más fácil de detectar, por lo que es una potencial herramienta de diagnóstico’, ha indicado Saura.
El siguiente paso es iniciar un estudio más amplio para recoger muestras de leche materna de 5 000 mujeres sanas a nivel mundial que se hayan quedado embarazadas con 40 años o más, o bien de cualquier edad que sean portadoras de mutaciones que aumentan su riesgo de padecer cáncer de mama (BRCA1, BRCA2, PALB2, RAD51C/D). El objetivo es corroborar si el cáncer de mama se puede detectar en una fase más temprana en la leche materna, incluso antes que mediante técnicas de imagen o analíticas de sangre.
Si los resultados son los esperados, Saura ha aventurado que se podría hacer un cribado a través de la leche materna a todas las mujeres después de dar a luz, al igual que se hace con los recién nacidos en la conocida como prueba del talón para detectar un grupo de enfermedades. ‘Pensamos que tendría utilidad, porque el cribado poblacional de cáncer de mama es a partir de los 50 años, mediante una mamografía, y esta nueva prueba se posicionaría en una población -más joven- en la que no estamos haciendo pruebas; y contra antes diagnostiquemos el cáncer, más posibilidad tenemos de curarlo’, ha subrayado.
Referencia
Saura S, Ortiz C, Matito J, Arenas JE, Suñol A, Martín A, et al. Early-Stage Breast Cancer Detection in Breast Milk. Cancer Discov 2023; https://doi.org/10.1158/2159-8290.CD-22-1340
Fuente: (Prensa Latina) – Tomado de la Selección Temática sobre Medicina de Prensa Latina. Copyright 2019. Agencia Informativa Latinoamericana Prensa Latina S.A.
ago
11
El sobrediagnóstico debe considerarse explícitamente al tomar decisiones de detección
Un estudio de más de 50.000 mujeres encontró que continuar con las pruebas de detección de cáncer de mama después de los 70 años se asoció con una mayor incidencia de cáncer que probablemente no habría causado síntomas durante la vida de la paciente. Estos hallazgos sugieren que el sobrediagnóstico puede ser común entre las mujeres mayores a las que se les diagnostica cáncer de mama después de la prueba de detección. El estudio se publica en Annals of Internal Medicine.
Estimación del sobrediagnóstico de cáncer de mama después de una mamografía de detección entre mujeres mayores en los Estados Unidos Read more