dic
2
Los expertos han sido capaces de visualizar, con detalle atómico, la estructura de un miembro de la familia de las proteínas HAT. Los resultados facilitarán el diseño de fármacos contra varias enfermedades prevalentes.
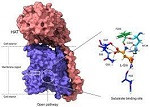 Los aminoácidos, los ladrillos básicos que permiten la vida, entran y salen de las células para que estas puedan crecer, dividirse y desarrollar sus funciones fisiológicas. Esta entrada y salida sucede gracias a las compuertas conformadas por, entre otras, las proteínas de la familia HAT, que se encuentran embebidas en la membrana celular.
Los aminoácidos, los ladrillos básicos que permiten la vida, entran y salen de las células para que estas puedan crecer, dividirse y desarrollar sus funciones fisiológicas. Esta entrada y salida sucede gracias a las compuertas conformadas por, entre otras, las proteínas de la familia HAT, que se encuentran embebidas en la membrana celular.
A pesar de que dichas proteínas son prácticamente idénticas en su estructura, unas transportan unos aminoácidos y no otros, lo que les confiere funciones completamente distintas, como aquellas relacionadas con el crecimiento de las células y su implicación en enfermedades como el cáncer, el funcionamiento de las neuronas o el transporte de sustancias tóxicas y su intervención en la adicción a sustancias como la cocaína.
“La naturaleza ha resuelto el problema de armonizar la concentración adecuada de cada aminoácido en sangre y en las células, y el flujo de aminoácidos entre células y órganos, con unos 60 transportadores distintos, que lógicamente son promiscuos y transportan varios pero no todos los aminoácidos”, explica a SINC Manuel Palacín, investigador del Instituto de Investigación Biomédica (IRB Barcelona).
Las proteínas HAT son prácticamente idénticas en su estructura. Sin embargo, unas transportan unos aminoácidos y no otros, lo que les confiere funciones distintas.
“Unos transportadores se expresan en unas células y otros en otras. Además, a tiempos distintos de nuestro desarrollo y envejecimiento. La especificidad en este escenario es necesaria, consustancial y paradigmática”, detalla a SINC el investigador, catedrático de la Universidad de Barcelona.
Tanto los científicos del IRB Barcelona como del Centro Nacional de Investigaciones Oncológicas (CNIO), se preguntaron qué es lo que confiere esta especificidad y diversidad de funciones. Por ello, analizaron la arquitectura tridimensional de esta importante familia de proteínas. Los resultados del estudio se publican en la revista Proceedings of the National Academy of Sciences (PNAS).
Detalles a escala atómica
Gracias a las últimas tecnologías de alta resolución estructural, como la criomicroscopía electrónica –combinadas con la modelización computacional y el diseño de mutantes de estas proteínas–, los autores han podido observar la estructura de uno de los miembros de esta familia de proteínas con detalle atómico y descifrar su función.
El detalle atómico desvela que solo unos pocos residuos ─cada uno de los aminoácidos que forman parte de estas proteínas─, situados en regiones muy concretas, son los responsables de dictar los aminoácidos a los que se unen y, por tanto, sus funciones específicas.
Los científicos han sido capaces de visualizar con resolución atómica, mediante el uso de criomicroscopía electrónica, la estructura de un miembro de la familia HAT.
Además, el trabajo demuestra cómo las sustituciones de unos residuos por otros en estas posiciones en los distintos miembros de la familia son responsables del cambio en la especificidad de reconocimiento y transporte de unos aminoácidos y no otros.
“Las técnicas más tradicionales para la determinación de la estructura de las proteínas, como las que utilizan rayos X, han tenido un éxito limitado con las proteínas que están embebidas en las membranas biológicas, por lo que muchas cuestiones han quedado sin resolver”, declara Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en la Respuesta al Daño del ADN del CNIO y coautor del trabajo.
“La [técnica] más exitosa es la criomicroscopía electrónica, donde literalmente se fotografían moléculas de la proteína en estado congelado. Es decir, se ‘ven’ los átomos en el espacio”, destaca Paladín.
Nuevos fármacos contra cáncer y alzhéimer
Esta nueva tecnología, galardonada con el Premio Nobel de Química en 2017, no solo ha servido para observar procesos biológicos como nunca antes, sino que también contribuye a acelerar el desarrollo de nuevos compuestos y fármacos de interés.
Solo unos pocos residuos son los responsables de dictar los aminoácidos a los que se unen y, por tanto, sus funciones específicas
Los resultados permitirán dirigir ahora los esfuerzos a conseguir nuevos medicamentos que actúen específicamente sobre regiones concretas de estas proteínas, y controlar las enfermedades en las que intervienen, como el cáncer o el alzhéimer.
“Resolver la estructura de proteínas es clave para entender su funcionamiento, pero el verdadero objetivo es conocer cómo funcionan, ya que si se altera este mecanismo se produce una patología”, concluye el investigador.
Referencia:
Rodríguez C. F:, Escudero-Bravo P., Díaz L.,Bartoccioni P., GarcíaC.: Structural basis for substrate specificity of heteromeric transporters of neutral amino acids. PNAS. 2021. DOI: 10.1073/pnas.2113573118
El trabajo, liderado por el IRB Barcelona y el CNIO, se ha llevado a cabo en colaboración con los grupos de Víctor Guallar, en el Barcelona Supercomputing Center (BSC) y Lucía Díaz de la empresa biotecnológica Nostrum Biodiscovery.

