sep
18
 La exposición prenatal a la contaminación del aire está relacionada con alteraciones en las proteínas que pueden detectarse después del nacimiento del bebé y que afectan procesos celulares como la autofagia, es decir la “autoalimentación” de células dañadas que se produce en respuesta al estrés.
La exposición prenatal a la contaminación del aire está relacionada con alteraciones en las proteínas que pueden detectarse después del nacimiento del bebé y que afectan procesos celulares como la autofagia, es decir la “autoalimentación” de células dañadas que se produce en respuesta al estrés.
La doctora Olga Gorlanova, médica investigadora del Hospital Infantil Universitario de la Universidad de Basilea, Suiza, también demostró en el Congreso Internacional de la European Respiratory Society (ERS) celebrado en Milán, Italia, que los bebés sanos recién nacidos y durante el embarazo exhibían características individuales y diferentes respuestas a las de sus madres respecto a la contaminación del aire (CA).
La exposición a contaminantes relacionados con el tráfico durante el embarazo puede afectar negativamente a la autofagia en recién nacidos sanos, según una presentación en el Congreso Internacional de la European Respiratory Society (ERS) celebrado en Milán entre el 9 y 13 de septiembre de 2023.
El hecho podría significar que algunos bebés son más vulnerables que otros, incluso si nacieron en hogares ubicados en zonas con niveles de relativa baja contaminación.
Los trabajos anteriores de Gorlanova y sus colegas habían demostrado que la exposición a la CA durante el embarazo podría afectar la función pulmonar y el sistema inmunológico de los recién nacidos.
En el estudio actual, observaron las proteínas involucradas en la autofagia, el envejecimiento y la remodelación celular, para analizar cómo la exposición prenatal podría afectarlas.
Participantes del estudio
Los investigadores midieron 11 proteínas encontradas en la sangre del cordón umbilical de 449 recién nacidos sanos del estudio de cohorte Bern Basel Infant Lung Development (BILD), iniciado en Berna en 1999.
Por entonces, el objetivo trazado consistió en reclutar hasta el año 2025 a 1 000 bebés con el fin de evaluar los efectos de la genética y el medio ambiente -en particular, la CA- en sus desarrollos pulmonares.
Los especialistas del trabajo presentado en ERS midieron la exposición de las madres al dióxido de nitrógeno (NO2) y a las partículas diminutas PM10, inferiores a 10 micrones de diámetro.
Al analizar las emisiones de los vehículos, el humo y el desgaste de neumáticos y frenos, entre otras fuentes contaminantes, descubrieron que tanto el NO2 como el PM10 estaban relacionados con cambios en las proteínas implicadas en la autofagia.
La exposición al NO2 se relacionó con una disminución de la actividad de las proteínas Sirtuina1 (SIRT1) e Interleucina-8 (IL-8), y un aumento de los niveles de la proteína Beclina-1.
“Nuestros resultados indican que el NO2, un contaminante formado principalmente por las emisiones del tráfico, está asociado con niveles elevados de proteína Beclina-1, que es fundamental para iniciar la autofagia. La exposición a niveles más altos de NO2 también se relacionó con niveles reducidos de SIRT1, proteína que desempeña un papel protector en la resistencia al estrés, la inflamación y el envejecimiento. La IL-8 es una proteína activa en determinadas células inflamatorias”, afirmó Gorlanova.
“Agrupamos a los bebés en cuatro grupos distintos, conformados en base a los niveles de contaminación expuestos mientras permanecían en el útero. Si bien las concentraciones de las proteínas eran similares, mantenían diferencias en su exposición a la contaminación del aire por NO2 y PM10.»
Un grupo se caracterizó por las concentraciones bajas de nueve proteínas, mientras que otro, formado por el siete por ciento de todos los bebés, contaba con niveles más altos de proteínas IL-8 e Interleucina 1 beta (IL-1B), participantes en procesos inflamatorios y de remodelación.
Ambos grupos de recién nacidos estuvieron expuestos a niveles más bajos, aunque diferentes, de CA prenatal respecto a los otros dos grupos.
Para los autores, sus hallazgos sugieren que los recién nacidos sanos poseen un patrón de respuesta individual a la CA, indicativo de mayor vulnerabilidad de algunos bebés respecto a otros.
Antecedentes y opiniones
El trabajo se sumaría a la creciente evidencia que involucra los mecanismos relacionados a la autofagia con la forma en que las células humanas reaccionan ante la CA. Los resultados, consistentes con la evidencia de investigaciones en tejidos y animales, inspira a sus autores a convocar mayores exploraciones de estos mecanismos con la intención de comprender mejor los efectos nocivos de la CA en los bebés.
Los investigadores planean examinar si los bebés con distintos patrones de respuesta proteica a la CA sufrirán más problemas respiratorios durante la infancia y la niñez en comparación con aquellos que no muestran las mismas respuestas proteicas.
Marielle Pijnenburg, profesora asociada de neumología pediátrica y jefa del Departamento de Medicina Respiratoria y Alergología Pediátrica del Centro Médico Erasmus de Rotterdam, Países Bajos, opinó sobre la investigación: “este estudio se suma a la creciente cantidad que prueba cómo la CA puede afectar la salud de los niños antes y después de su nacimiento; en tal sentido muestra que los mecanismos relacionados con la autofagia pueden estar involucrados en el tipo de reacción de las células humanas a tal contaminación.»
La especialista que no participó en el trabajo, añadió: “sin embargo, reunimos suficiente evidencia de este y otros estudios para enviar un mensaje contundente a los gobiernos y a los responsables políticos: la CA daña la salud de las personas y sus efectos pueden apreciarse con anterioridad al nacimiento. Todos deberíamos redoblar nuestros esfuerzos para reducirla lo antes posible. Esta conducta no sólo mejoraría la salud pública y reduciría los costos asociados Al tratamiento de enfermedades causadas por la CA, sino que también ayudará al medio ambiente”.
Por su parte, Olga Gorlanova, primera autora del estudio, aclaró en un comunicado de la ERS:
«El estudio no es un proyecto científico independiente; trabajamos dentro de un gran grupo de investigación con sede en Suiza y también colaboramos con varios otros internacionales. Es decir, somos parte de un esfuerzo más amplio, unidos para una mejor concepción del desarrollo pulmonar en fetos, bebés y niños mayores, atentos a cómo el medio ambiente (incluida la CA) afecta la salud humana”.
Referencia
Gorlanova O, Oller H, Nahum U, Künstle N, Müller L, Marten A, et al. Prenatal exposure to air pollution affects newborns’ autophagy, senescence and remodelling proteins. Congreso Internacional de la European Respiratory Society (ERS), 2023. https://k4.ersnet.org/prod/v2/Front/Program/Session?e=379&session=16448
15/09/2023
Fuente: (SIIC Salud) Noticias biomédicas Copyright siicsalud© 1997-2023
sep
18
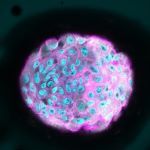 Un estudio liderado pr el Instituto de Bioingeniería de Cataluña demuestra que la laminina, una proteína presente en los tejidos mamarios sanos, evita los efectos del endurecimiento, protegiendo a las células contra el crecimiento tumoral.
Un estudio liderado pr el Instituto de Bioingeniería de Cataluña demuestra que la laminina, una proteína presente en los tejidos mamarios sanos, evita los efectos del endurecimiento, protegiendo a las células contra el crecimiento tumoral.
Las células son capaces de transformar cambios mecánicos en respuestas biológicas. Este proceso se conoce cómo mecanotransducción y tiene un papel fundamental en la evolución de los tumores sólidos, como el cáncer de mama.
Se sabe que un cambio mecánico habitual en procesos de cáncer es el endurecimiento de los tejidos. Esta rigidez es precisamente lo que se detecta al hacer una autoexploración o palpación mamaria, para detectar posibles tumores. La rigidez del tejido mamario provoca una reacción en cadena, generando tensión en el interior de las células y deformando su núcleo. En última instancia, la deformación del núcleo activa genes que controlan la proliferación celular y están relacionados con el crecimiento tumoral.
Un estudio publicado hoy en la revista Nature Materials demuestra un me4canismo celular que podría ser clave para frenar el avance de los tumores de mama. Los resultados del trabajo, liderado por Pere Roca-Cusachs, investigador principal del Instituto de Bioingeniería de Cataluña (IBEC) y la Universidad de Barcelona, indican que la laminina, una proteína que da consistencia y soporte a los tejidos mamarios sanos, dificulta el proceso de mecanotransducción en las células, protegiendo al núcleo de ser deformado.
“Nuestros resultados muestran que la presencia de laminina evita los efectos de la rigidez. Es decir, que protege a las células contra el crecimiento tumoral. Demostramos este mecanismo in vitro, pero creemos que también podría funcionar in vivo ya que existe una concordancia con lo observado en muestras de pacientes de cáncer de mama.”, explica Zanetta Kechagia, investigadora postdoctoral del IBEC y primera autora del estudio.
“A partir de este mecanismo, que hemos demostrado que previene la invasión de células tumorales, se podrían diseñar herramientas diagnósticas más sensibles o nuevas terapias potenciales contra el cáncer de mama. Para ello, será necesario seguir investigando.”, añade Pere Roca-Cusachs, investigador del IBEC, profesor agregado Serra-Hunter de la Universidad de Barcelona (UB) y líder del estudio.
Ya se ha demostrado que un incremento en la rigidez del tejido induce respuestas mecánicas en el interior de las células. Las más habituales están relacionadas con cambios en el citoesqueleto de las células para interaccionar con el tejido y migrar, así como con la activación de la proteína YAP, que entra en el núcleo accionando genes relacionados con la proliferación celular.
Para estudiar el proceso de mecanotransducción, el equipo de investigación sembró células de tejido mamario sobre geles con rigidez variable para simular tejidos sanos (blandos) y malignos (rígidos). Compararon el comportamiento de las células sobre geles cubiertos con laminina y geles cubiertos con colágeno o fibronectina, otras proteínas de soporte celular que se producen en exceso en procesos cancerígenos.
Así, los investigadores observaron que las células sembradas sobre el gel rico en laminina tuvieron una respuesta mecánica muy leve a la rigidez del sustrato, en comparación a aquellas sembradas sobre los geles ricos en colágeno y fibronectina.
Este trabajo forma parte del proyecto europeo MECHANO·CONTROL , con una financiación de más 7 millones de euros dentro del marco de los proyectos europeos FET (Tecnologías Futuras y Emergentes).
“Estos resultados son la culminación de más de 6 años de trabajo, en los que hemos contado con el apoyo de la Comisión Europea y un equipo de instituciones internacionales, con el IBEC a la cabeza, para entender cómo las fuerzas mecánicas afectan al cáncer de mama.” Daniel Caudepón, gestor de proyectos del IBEC encargado del proyecto MECHANO·CONTROL.
El trabajo incluye contribuciones importantes de otras instituciones involucradas en MECHANO-CONTROL, con el trabajo de Pablo Sáez y Marino Arroyo (Universitat Politècnica de Catalunya), y Thijs Koorman y Patrick Derksen (University Medical Center Utrecht, Países Bajos).
Referencia
Kechagia Z, Sáez P, Gómez-González M, Canales B, Viswanadha S, Zamarbide M, et al. The laminin–keratin link shields the nucleus from mechanical deformation and signalling. Nat Mater. 2023. https://doi.org/10.1038/s41563-023-01657-3
https://www.nature.com/articles/s41563-023-01657-3
14/09/2023
Fuente: EurekaAlert Tomado News Releases Copyright © 2023 by the American Association for the Advancement of Science (AAAS)

