ago
28
Un estudio con participación del Consejo Superior de Investigaciones Científicas (CSIC) y el Instituto de Investigación Biomédica (IRB Barcelona) ha descifrado la estructura y el mecanismo de actuación de un complejo clave en la infección del virus bacteriófago T7. Los resultados se publican en la revista Nature Communications.
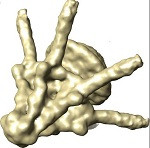 El trabajo es fruto de la colaboración de expertos en criomicroscopía electrónica del Centro Nacional de Biotecnología (CSIC), dirigidos por José L. Carrascosa, y en cristalografía de rayos X del Instituto de Biología Molecular de Barcelona (CSIC) y el Instituto de Investigación Biomédica (IRB Barcelona), dirigidos por Miquel Coll. Los diferentes grupos de investigación han trabajado de manera conjunta para combinar los resultados de ambas técnicas, obteniendo nuevos datos sobre el mecanismo de actuación de esta proteína en el proceso de maduración viral.
El trabajo es fruto de la colaboración de expertos en criomicroscopía electrónica del Centro Nacional de Biotecnología (CSIC), dirigidos por José L. Carrascosa, y en cristalografía de rayos X del Instituto de Biología Molecular de Barcelona (CSIC) y el Instituto de Investigación Biomédica (IRB Barcelona), dirigidos por Miquel Coll. Los diferentes grupos de investigación han trabajado de manera conjunta para combinar los resultados de ambas técnicas, obteniendo nuevos datos sobre el mecanismo de actuación de esta proteína en el proceso de maduración viral.
Los bacteriófagos son virus que infectan a bacterias. Además de su interés como modelo de estudio por su simplicidad genética pero gran complejidad estructural, ahora mismo son un nuevo foco de atención para los investigadores dado su potencial como alternativa al uso de antibióticos, explica José L. Carrascosa, investigador del Centro Nacional de Biotecnología y codirector del trabajo.
Durante el ciclo del bacteriófago T7 se forma una cápsida viral donde el virus necesita incluir su material genético, introduciéndolo a través de un pequeño canal de entrada formado por la proteína portal que posteriormente se cierra con la proteína de la cola del virus. Hasta ahora se desconocía cuál era el mecanismo que permitía abrir y cerrar esta puerta de entrada de manera controlada.
Estos virus bacterianos tienen un mecanismo para empaquetar su ADN similar a los de los virus herpes que infectan humanos. Por ello, descifrar cómo funcionan ayuda a entender cómo actúan virus patógenos que nos afectan, indica Miquel Coll, investigador del Instituto de Biología Molecular de Barcelona y del IRB Barcelona y codirector del estudio.
Ana Cuervo, investigadora del Centro Nacional de Biotecnología, y Montserrat Fàbrega-Ferrer, del IRB Barcelona y del Instituto de Biología Molecular de Barcelona, primeras autoras del trabajo, destacan cómo combinando criomicroscopía electrónica y cristalografía de rayos X de sincrotrón nos ha permitido no sólo resolver la estructura atómica de un complejo de gran tamaño, lo que supone un desafío técnico, sino también definir un modelo de apertura y cierre del portal durante el proceso de maduración de la cápsida viral.
De esta forma, los científicos han podido identificar cuáles son las interacciones entre las diferentes proteínas que permiten los cambios en la conformación del complejo, desde una estructura abierta para permitir el paso del ADN viral a una cerrada al formar las partículas virales maduras.
Este trabajo ha contado con la financiación del programa de excelencia Severo Ochoa y María de Maeztu, el programa Ramón y Cajal del Ministerio de Ciencia, Innovación y Universidades, y los proyectos europeos iNEXT y Instruct-ERIC.
Artículo de referencia:
Cuervo A., Fàbrega-Ferrer M. , Machón C., Conesa J. J. and cols..: Structures of T7 bacteriophage portal and tail suggest a viral DNA retention and ejection mechanism. Nature Communications.
DOI: 10.1038/s41467-019-11705-9ª

