sep
18
La inmunoterapia con células CAR T que ha revolucionado el tratamiento de ciertos cánceres podría reposicionarse para otras enfermedades, como las cardíacas.
 ¿Podría el tratamiento con células CAR T ser útil en la enfermedad cardíaca?. Un grupo de investigadores de la Universidad de Pensilvania se plantea esta hipótesis en un experimento, cuyos resultados se publican en Nature.
¿Podría el tratamiento con células CAR T ser útil en la enfermedad cardíaca?. Un grupo de investigadores de la Universidad de Pensilvania se plantea esta hipótesis en un experimento, cuyos resultados se publican en Nature.
La conclusión es que este tipo de inmunoterapia, por el momento restringido a los cánceres hematológicos, podría ser una opción terapéutica frente a la fibrosis cardíaca, afección que acelera la progresión de la insuficiencia cardíaca.
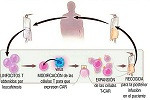
La investigación, realizada en ratones, ha empleado células CAR T que modificaron genéticamente para atacar y eliminar los fibroblastos activados que contribuyen al desarrollo de la fibrosis. De esta forma, redujeron de forma significativa la cicatrización y restablecieron la función cardíaca en un modelo murino de cardiopatía causada por hipertensión arterial.
Nuestro trabajo sugiere que la revolución inmunológica que en los últimos años ha supuesto un notable avance en el tratamiento del cáncer se extenderá mucho más allá de la oncología. Nuestros resultados son un ejemplo de cómo este conocimiento para modificar el sistema inmunológico ofrece nuevas opciones terapéuticas para muchas enfermedades humanas”, expone a DM el autor principal del trabajo, Jonathan A. Epstein, que es profesor de investigación cardiovascular William Wikoff Smith en la Universidad de Pensilvania. Precisamente en el Centro de Cáncer Abramson de esta universidad se desarrolló lo que terminó siendo la primera terapia con linfocitos CAR T aprobada en el mundo, tisagenlecleucel (Kymriah).
Casi todos los órganos y tejidos pueden verse afectados por una fibrosis excesiva (entre las enfermedades asociadas están cirrosis hepática, artritis, enfermedad renal crónica) para la que hay pocos tratamientos, por no decir ninguno. La posibilidad de contar con una estrategia para atacar la fibrosis con células CAR T es emocionante. Pensamos que tiene implicaciones más allá de la enfermedad cardíaca, pues también podría utilizarse a las numerosas enfermedades fibróticas sin tratamiento y que causan una gran morbilidad y mortalidad. Con todo, Epstein advierte de que aún se necesita más investigación para poder introducir esta estrategia en un entorno clínico.
Las células CAR T se modificaron para que reconocieran la proteína de activación de fibroblastos (FAP). La selección de esta glucoproteína de la superficie celular se realizó cotejando la base de datos de secuencias de ARN con los datos de expresión génica de enfermos con enfermedades cardíacas.
Esta proteína es, para Epstein, un objetivo atractivo por varias razones, como el hecho de que en circunstancias normales, no se expresa en gran medida en otras partes del cuerpo, lo que limita las potenciales toxicidades no deseadas. Además, la FAP se expresa de forma clara en los fibroblastos cardíacos activados tras la lesión, como hemos visto en pacientes con insuficiencia cardíaca, pero no en los normales de un corazón sano. Por otro lado, FAP es una molécula de la superficie celular, lo que facilita que las células T modificadas se dirijan a su objetivo. No obstante, para poder afianzar las posibilidades de poner en marcha este tratamiento en la clínica, también exploran otras opciones. Hemos identificado una serie de proteínas que podrían ser objetivos terapéuticos, solos o en combinación, para enfermos con insuficiencia cardíaca.
Las células CAR T modificadas para dirigirse a FAP alcanzaron en un mes una reducción significativa de la fibrosis cardíaca en los ratones, así como mejoras en la función diastólica y sistólica.
El hecho de que la cardiotoxicidad sea uno de los efectos secundarios de estos tratamientos no es óbice para seguir explorando la terapia con CAR T en el ámbito cardíaco. Así lo reconoce Epstein, quien considera que explorar y limitar las toxicidades será una parte importante en el proceso de translación de este trabajo a la clínica. En nuestro modelo de ratón, buscamos específicamente cardiotoxicidad y no encontramos evidencia de que hubiera. Si elegimos dianas diferentes o adicionales, tendremos que asegurarnos de que la expresión se limite a las células que queremos destruir y no a otras.
setiembre 17/2019 (Diario Médico)

