dic
26
La compañía farmacéutica Ferrer ha recibido la aprobación de la Agencia de Alimentos y Fármacos de los Estados Unidos (FDA) para la comercialización de Ozenoxacino en crema (1 %) en Estados Unidos, a través de Medimetriks Pharmaceuticals, Inc bajo la marca Xepi.
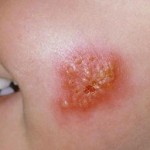 Está indicado como tratamiento tópico del impétigo causado por Staphylococcus aureus o Streptococcus pyogenes en pacientes pediátricos y adultos. El compromiso de Ferrer es seguir investigando para desarrollar nuevas indicaciones y usos de este principio activo por vía tópica, tanto para infecciones de la piel como para otro tipo de infecciones, en monoterapia o en terapia combinada. Éste es un medicamento de prescripción que ha recibido la aprobación de la FDA para administrarse a bebés a partir de los dos meses de edad. Se han realizado estudios para demostrar la eficacia y la seguridad pediátrica del producto en pacientes a partir de los dos meses de edad, mostrando un perfil de seguridad similar al de los pacientes adultos.
Está indicado como tratamiento tópico del impétigo causado por Staphylococcus aureus o Streptococcus pyogenes en pacientes pediátricos y adultos. El compromiso de Ferrer es seguir investigando para desarrollar nuevas indicaciones y usos de este principio activo por vía tópica, tanto para infecciones de la piel como para otro tipo de infecciones, en monoterapia o en terapia combinada. Éste es un medicamento de prescripción que ha recibido la aprobación de la FDA para administrarse a bebés a partir de los dos meses de edad. Se han realizado estudios para demostrar la eficacia y la seguridad pediátrica del producto en pacientes a partir de los dos meses de edad, mostrando un perfil de seguridad similar al de los pacientes adultos.
“Esta aprobación representa un gran avance en el tratamiento del impétigo, que continúa siendo un problema común a nivel mundial, en especial en bebés y niños”, aseguró Jordi Ramentol, CEO de Ferrer. “Desde Ferrer queremos proporcionar a la población pediátrica y a cualquier persona que sufra de impétigo una novedosa alternativa para su tratamiento tópico. Además, Ozenoxacino puede tener en un futuro un mayor recorrido en el tratamiento de otras patologías infecciosas”.
El plan de desarrollo clínico de ozenoxacino ha contado con 17 estudios, en los cuales han participado 923 pacientes (adultos y pediátricos a partir de dos meses de edad afectados de impétigo) y 454 voluntarios sanos. Los resultados de los estudios preclínicos y clínicos se han publicado en revistas científicas de renombre internacional, incluyendo las prestigiosas Journal of Antimicrobial Chemotherapy y Future Microbiology.
Ozenoxacino, formulado como crema tópica (1%), tiene varias solicitudes de patente en diferentes países, algunas pendientes y otras aprobadas. En EE.UU. cuenta con patentes concedidas tanto de producto como de formulación, cuyas fechas de expiración se ampliarán tras la aprobación para la comercialización. Este año, el producto también ha recibido la aprobación para comercializarse en Europa y Canadá, bajo las marcas Dubine, Ozadub y Ozanex.
diciembre 25/2017 (immedicohospitalario.es)

