may
10
La compañía biotecnológica Shire ha anunciado que la Administración de Alimentos y Fármacos de Estados Unidos (FDA) ha concedido un procedimiento de evaluación rápida para su compuesto SHP655, un factor Adamts13 recombinante para el tratamiento de episodios agudos de la enfermedad púrpura trombótica trombocitopénica en pacientes con un déficit estructural de la proteasa de escisión del factor de Willebrand (FVW).
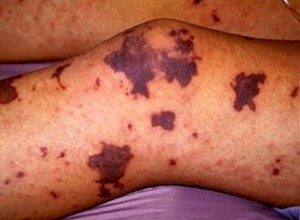 La designación de evaluación rápida por la FDA está respaldada por datos preclínicos y por un ensayo fase 1. El proceso para ello está diseñado para facilitar el desarrollo y acelerar la revisión de fármacos utilizados en enfermedades graves y abordar una necesidad médica no cubierta. Sin embargo, no garantiza que la FDA vaya a autorizar en última instancia el compuesto ni indica el momento de dicha aprobación.
La designación de evaluación rápida por la FDA está respaldada por datos preclínicos y por un ensayo fase 1. El proceso para ello está diseñado para facilitar el desarrollo y acelerar la revisión de fármacos utilizados en enfermedades graves y abordar una necesidad médica no cubierta. Sin embargo, no garantiza que la FDA vaya a autorizar en última instancia el compuesto ni indica el momento de dicha aprobación.
La designación de evaluación rápida por la FDA está respaldada por datos preclínicos y por un ensayo fase 1. El proceso para ello está diseñado para facilitar el desarrollo y acelerar la revisión de fármacos utilizados en enfermedades graves y abordar una necesidad médica no cubierta. Sin embargo, no garantiza que la FDA vaya a autorizar en última instancia el SHP655 ni indica el momento de dicha aprobación.
Shire iniciará un ensayo de fase 3 con SHP655 con un diseño aleatorizado, abierto, cruzado, de 2 periodos, con una continuación de un solo grupo para evaluar la seguridad y la eficacia de SHP655 en el tratamiento y la prevención de los episodios agudos de PPT en pacientes con déficit hereditario grave de Adamts13. Este estudio mundial se realizará en Estados Unidos, Europa y Japón.
mayo 9/2017 (diariomedico.com)

