feb
17
Investigadores del Sincrotrón ALBA y de la Universidad Autónoma de Barcelona han analizado con luz de sincrotrón cómo son, dónde se localizan y qué efectos tienen diferentes agregados de la enfermedad de Alzheimer en neuronas In vitro.
 Los resultados, publicados en la revista Analytical Chemistry, abren una nueva vía para conocer mejor cómo se desarrolla esta enfermedad que afecta a más de 30 millones de personas en el mundo.
Los resultados, publicados en la revista Analytical Chemistry, abren una nueva vía para conocer mejor cómo se desarrolla esta enfermedad que afecta a más de 30 millones de personas en el mundo.
Pérdida de memoria, dificultad para comunicarse, cambios en la personalidad o problemas de orientación. Estos son síntomas comunes en nuestra sociedad, ya que 30 millones de personas en el mundo y 1,5 en España sufren los efectos del alzhéimer, según datos de la Organización Mundial de la Salud (OMS) y de la Confederación Española de Asociaciones de Familiares de Personas con Alzheimer y otras demencias (CEAFA), respectivamente. El alzhéimer es la causa más importante de demencia y se describe como una enfermedad multifactorial que lleva a la muerte neuronal. En la actualidad no hay un tratamiento efectivo para combatirla ni prevenirla.
Cuando una persona padece alzhéimer, se forman placas amiloides en su cerebro, compuestas por unos depósitos o agregados del péptido beta amiloide. Este péptido -que proviene de una proteína necesaria para el funcionamiento celular- tiene tendencia a agregarse adoptando distintos tamaños y morfologías, dependiendo de las condiciones físico-químicas que lo rodean. Aunque se sabe que la presencia del péptido betaamiloide junto con otros factores como el estrés oxidativo tienen un papel clave en el inicio y desarrollo del alzhéimer, no se conoce cuáles son la causa y cuáles la consecuencia.
Para conocer mejor cómo funcionan los mecanismos mediante los cuales las proteínas y los péptidos amiloides se convierten en tóxicos, investigadores del Sincrotrón ALBA y del grupo de Biología estructural del Alzheimer de la Universidad Autónoma de Barcelona (UAB), en colaboración con científicos del sincrotrón europeo ESRF, han llevado a cabo experimentos con luz infrarroja en los sincrotrones de Barcelona y Grenoble. La luz infrarroja es absorbida por los enlaces de las moléculas, lo que permite conocer cuál es la composición química de una muestra.
“Este trabajo ha ayudado a dar fuerza a la hipótesis de que los péptidos amiloides, especialmente en formas no fibrilares, son capaces de oxidar las células y que esto puede ser un punto clave para el desarrollo de la enfermedad. Gracias a la luz infrarroja, no solo hemos podido analizar los efectos de estos agregados sino que también hemos podido relacionarlos con la estructura que adoptan los péptidos cuando forman distintos agregados, lo que puede ser muy útil para identificar las formas tóxicas causantes de la enfermedad”, explica Núria Benseny, investigadora de la línea de luz MIRAS del Sincrotrón ALBA.
Mayor resolución espacial gracias al sincrotrón
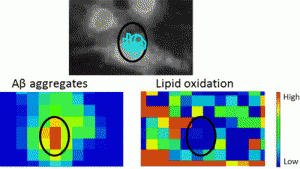
El hecho de conectar un microscopio a la luz infrarroja permite conocer, además, la distribución química. Gracias a la elevada brillantez de la luz de sincrotrón, esta distribución se puede medir a mayores resoluciones espaciales. Con esta técnica se ha analizado el efecto de dos tipos de agregados del péptido amiloide (fibrilares y amorfos) en células neuronales cultivadas.
Los resultados indican que los agregados amorfos provocan un grado de oxidación superior a los otros y, por primera vez, han obtenido la ubicación in situ de estos agregados en células cultivadas. Estas conclusiones son coherentes con investigaciones previas realizadas con muestras de cerebro de afectados, donde se veía que la oxidación era más alta en las regiones que rodeaban las placas amiloides y concuerdan con la hipótesis de que son los péptidos amiloides los causantes de la oxidación celular que está asociada a la enfermedad de Alzheimer.
Este estudio ha servido para dar un paso más en la caracterización de estos agregados amorfos y considerarlos como un agente potencial tóxico en el inicio y desarrollo de la enfermedad.
febrero 16/ 2018 (SINC)

