jul
18
Investigadores del Centro Nacional de Investigaciones Cardiovasculares Carlos III (CNIC) hallan algunas claves para optimizar la inmunoterapia, tratamiento que ha revolucionado el manejo del cáncer. El estudio, publicado en Nature Communications, demuestra que la generación de memoria residente en tejidos colabora con la memoria circulante en la inmunidad contra tumores.
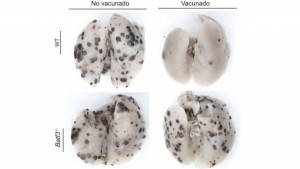 Un estudio de del CNIC, publicado en Nature Communications, revela que para producir una respuesta inmunitaria óptima frente al cáncer hace falta la colaboración entre dos tipos de ‘memoria inmunitaria’, circulante en sangre y residente en tejidos, que se pueden reactivar con los tratamientos actuales de inmunoterapia. En concreto, los investigadores han comprobado cómo colaboran un tipo de célula fundamental en la respuesta inmunitaria y los linfocitos T CD8+ de memoria para generar mayor actividad antitumoral. Los resultados de la investigación podrían servir para mejorar las estrategias actuales de inmunoterapia del cáncer, con especial interés en la prevención de la metástasis (diseminación del tumor a otros órganos distintos del lugar donde se originó).
Un estudio de del CNIC, publicado en Nature Communications, revela que para producir una respuesta inmunitaria óptima frente al cáncer hace falta la colaboración entre dos tipos de ‘memoria inmunitaria’, circulante en sangre y residente en tejidos, que se pueden reactivar con los tratamientos actuales de inmunoterapia. En concreto, los investigadores han comprobado cómo colaboran un tipo de célula fundamental en la respuesta inmunitaria y los linfocitos T CD8+ de memoria para generar mayor actividad antitumoral. Los resultados de la investigación podrían servir para mejorar las estrategias actuales de inmunoterapia del cáncer, con especial interés en la prevención de la metástasis (diseminación del tumor a otros órganos distintos del lugar donde se originó).
La inmunoterapia, el uso del propio sistema inmunitario para luchar contra el cáncer, está revolucionando el tratamiento de esta enfermedad. De hecho, fue elegida por la prestigiosa revista científica Science como el mayor avance científico del año 2013. «El cáncer escapa al control del sistema inmunitario porque los linfocitos T citotóxicos, que podrían reconocer y eliminar células tumorales, se encuentran inhibidos. La inmunoterapia actual se basa en reactivar dichos linfocitos T; sin embargo, no se conoce bien cómo se pueden generar estos linfocitos T citotóxicos de manera más efectiva y, en particular, cómo se puede desencadenar memoria inmunitaria que permita prevenir el desarrollo de un tumor o de metástasis.», ha comentado David Sancho, líder del grupo de trabajo donde se ha desarrollado este descubrimiento.
Usando distintos métodos de vacunación, los investigadores del CNIC han generado linfocitos T citotóxicos de memoria específica contra el tumor. De este modo, dependiendo del método de vacunación, se pueden obtener linfocitos T de memoria que circulan entre la sangre y los tejidos, o linfocitos T de memoria que residen en los tejidos y no recirculan. Los linfocitos citotóxicos de memoria residente en tejidos, aclaran los investigadores, son más eficientes en la lucha contra reinfecciones virales, capacidad de inmunidad anti-tumoral desconocida hasta ahora.
Míchel Enamorado, primer autor de la publicación, ha explicado que «en este estudio hemos comparado la eficiencia en inmunidad anti-tumoral de ambos tipos de memoria de linfocitos T, circulante y residente. Y hemos encontrado que existe una colaboración entre ambos tipos de memoria con el fin de obtener una óptima respuesta. La memoria residente genera un estado de alerta que atrae y reactiva a la memoria circulante, de manera que la respuesta inmunitaria es más rápida y efectiva».
Transferencia adoptiva de linfocitos T
Otro método que ya se utiliza para la inmunoterapia del cáncer es la transferencia adoptiva de linfocitos T, específicos contra el cáncer. Los autores han demostrado que la transferencia de memoria circulante es capaz de transformarse en memoria residente en situaciones de infección y también en el contexto tumoral. Además, la combinación de esta transferencia con una de las estrategias actuales usadas en clínica, que utiliza el anticuerpo frente al receptor PD-1 para reactivar la respuesta antitumoral del linfocito T, aumenta la eficacia de la inmunoterapia.
Las conclusiones del estudio destacan que la generación de una respuesta inmunitaria óptima frente al cáncer requiere la generación tanto de memoria circulante como residente, que se pueden reactivar con los tratamientos actuales de inmunoterapia y que requieren de células dendríticas DC1 para su reactivación. La inmunoterapia del cáncer no solo representa un tratamiento que puede ser efectivo para rechazar tumores primarios, sino que sobre todo será fundamental para impedir el desarrollo de metástasis tras la resección del tumor.
julio 17/2017 (diariomédico.com)

