oct
13
Científicos liderados por el Dr. Salvador Aznar-Benitah, jefe del laboratorio de Células Madre y Cáncer del Institute for research in Biomedicine (IRB) Barcelona, han descrito las alteraciones que se producen durante la formación de las glándulas mamarias cuando la heterocromatina (la parte del ADN que no produce proteínas activamente) está mal regulada.
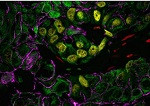 Los resultados, que han sido publicados en la revista Cell Stem Cell, indican que un empaquetado incorrecto del ADN hace que los retrotransposones (un tipo de elemento transponible originado en fragmentos ancestrales de virus integrados en el genoma celular) sean más accesibles.
Los resultados, que han sido publicados en la revista Cell Stem Cell, indican que un empaquetado incorrecto del ADN hace que los retrotransposones (un tipo de elemento transponible originado en fragmentos ancestrales de virus integrados en el genoma celular) sean más accesibles.
Al ser más accesibles, estos fragmentos pueden ser «leídos» y copiados por la maquinaria celular. La célula reacciona a la presencia de estos fragmentos virales como si estuviera sufriendo una infección y desencadena una respuesta inmune a través de un programa celular llamado piroptosis. Como resultado, las interacciones entre las diferentes células se alteran en la mama, dando lugar a una disfunción y a la total incapacidad de secretar de leche.
«En muchos tipos de cáncer, como el cáncer de mama triple negativo, observamos que hay regiones del genoma que se despliegan de un modo inesperado, y necesitamos entender las implicaciones que tiene. La respuesta inflamatoria y las alteraciones que surgen podrían desempeñar un papel esencial en la capacidad de estas células para colonizar otros órganos, provocando lo que se conoce como metástasis», explica el Dr. Aznar-Benitah, investigador ICREA del IRB Barcelona.
La compactación y la función del ADN
La función principal del ADN en nuestras células es coordinar la producción de las proteínas, que son las encargadas de ejecutar las funciones celulares. Sin embargo, algunas partes del genoma están muy condensadas, y no se utilizan para este propósito. Este estudio, así como otros publicados por la comunidad científica, señala que una regulación adecuada de la compactación de la cromatina también es clave para el correcto desarrollo de los tejidos.
El ADN de los animales que no codifica para proteínas contiene elementos transponibles, que son virus ancestrales que se integraron en el genoma hace mucho tiempo. El hecho de que estos elementos sean «leídos» y copiados por la maquinaria celular es perjudicial para la célula. Por ello, la célula ha desarrollado mecanismos para protegerse a sí misma.
Uno de los mecanismos que evita la copia de estos elementos en las células sanas es la compactación de la cromatina. En su último trabajo, el Dr. Aznar-Benitah y su equipo demostraron que bloquear esta compactación y liberar estos fragmentos de virus ancestrales no solo es perjudicial para la célula individual, sino que también repercute en la función de todo el tejido (y, tal vez, incluso del organismo).
Acercar la investigación a la práctica clínica
La Dra. Alexandra Avgustinova, primera autora del artículo y alumna del IRB Barcelona, ha puesto en marcha su propio laboratorio en el programa de Cáncer Pediátrico del Institut de Recerca Sant Joan de Déu (IRSD). Su grupo aborda la regulación del genoma en la aparición del cáncer pediátrico y, en este contexto, estudiará la influencia de elementos transponibles como los retrotransposones en la capacidad de respuesta de los cánceres pediátricos a la inmunoterapia.
«Durante los años que pasé en el IRB Barcelona, aprendí mucho y tuve la oportunidad de conocer a científicos destacados con los que me gustaría colaborar en el futuro. Trabajar con Salva me ha enseñado a «pensar en grande» y a perseguir realmente las preguntas que me intrigan, lo cual es muy importante a la hora de dirigir tu propio grupo», afirma la Dra. Avgustinova.
Técnicas desarrolladas y futuras líneas de estudio
Para llevar a cabo esta investigación, los científicos del laboratorio de Células Madre y Cáncer del IRB Barcelona han tenido que desarrollar un modelo de estudio muy complejo: utilizaron herramientas computacionales capaces de identificar los elementos transponibles dentro de una célula, en combinación con un modelo de ratón en el que podían evaluar las consecuencias funcionales de interrumpir la compactación de la cromatina.
Este estudio demuestra que la alteración de la compactación de la cromatina puede tener repercusiones que van más allá de la célula afectada, y allana el camino para la investigación de los procesos metastásicos de tumores con compactación de cromatina alterada y, por tanto, desregulación de elementos transponibles.
Los laboratorios del Dr. Juan M. Vaquerizas (Max Planck Institute for Molecular Biomedicine, Muenster) y del Dr. Holger Heyn (CNAG-CRG, Barcelona) y científicos de otros laboratorios, como la Dra. Alexandra Van Keymeulen (Université Libre de Bruxelles, Bruxelles), participaron en el trabajo. También colaboró la Plataforma de Histopatología del IRB Barcelona, liderada por la Dra. Neus Prats.

